الحمض النووي الريبوزي منقوص الأكسجين السرطاني الدوراني
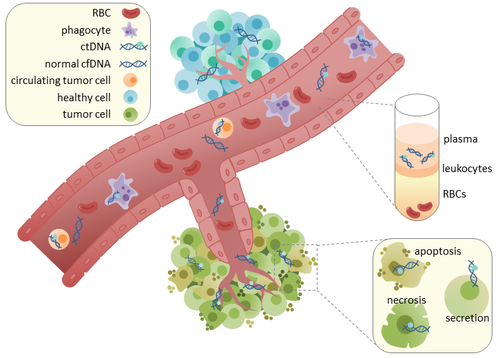
الحمض النووي الريبوزي منقوص الأكسجين السرطاني الدوراني (اختصاراً: ctDNA) هو حمض نووي ريبوزي منقوص الأكسجين متحلل في تيار الدم. آلية تحرر هذا الحمض النووي السرطاني الدوراني ctDNA إلى الدم مجهولة حتى الآن ويُفتَرَض أنه بسبب تنخر الخلية necrosis أو بسبب الموت الخلوي الذاتي المبرمج apoptosis أو بسبب الإفرازات الفعَّالة للخلايا السرطانية. عندما يتم عزله يمكن سلسلته لتحليل الطفرات التي طرأت عليه. الحمض النووي السرطاني الدوراني ctDNA هو جزء مشتق من الحمض النووي السرطاني الأصلي ولا علاقة له بالخلايا ولا يمكن خلطه مع الحمض النووي عديم الخلية cfDNA وهو مصطلح يصف حمضاً نووياَ موجود بشكله الحر في المجرى الدموي ولا يكون أصله بالضرورة سرطانياً وذلك لأن الحمض النووي السرطاني الدوراني ctDNA يمكن أن يعطينا كامل الحروف الوراثية المكوِّنة له ولهذا جلب أنظارالاهتمام إليه لضرورة دراسته السريرية. «الخزعات السائلة» هي أحد أشكال سحب الدم ويتم اجراؤها في أوقات مختلفة لمراقبة تطور الورم السرطاني خلال نهج العلاج.
ينحدر هذا الحمض النووي السرطاني الدوراني ctDNA مباشرة من الورم أو من الخلايا السرطانية التي تكون في المجرى الدموي (CTCs) وهي خلايا سرطانية حيوية يتم طرحها من ورم بدئي لتدخل المجرى الدموي أو اللمفاوي. الآلية الدقيقة لكيفية تحرر هذا الحمض النووي السرطاني الدوراني ctDNA غير واضحة حالياً ويُفتَرض أن العمليات الحيوية هي سبب تحرره مثل التنخر الخلوي أو الموت الخلوي الذاتي المبرمج للخلايا أو من الإفرازات الفعالة للخلايا السرطانية. الدراسات التي أُجريت على البشر (الأصحاء والمرضى) والفئران ذات الطعوم الأجنبية أظهرت أن أجزاء الحمض النووي عديم الخلية cfDNA طوله تقريبا 166bp وهو متوافق مع طول الحمض النووي الملتف حول الجسيم النووي بالإضافة للرابط. إن اقتطاع هذا الطول من الحمض النووي دليل على حدوث تفكك الحمض النووي الذي اشتق منه وهذا يتقرح أن التموت الخلوي الذاتي المبرمج هو الطريقة الأساسية التي تحررت فيها أجزاء الحمض النووي السرطاني الدوراني ctDNA.
في الأنسجة السليمة، الخلايا اللمفاوية البالعة تخترق النسج وهي مسؤولة عن إزالة بقايا التموت الخلوي الذاتي المبرمج أو التنخر الخلوي وذلك يتضمن الحمض النووي السرطاني الدوراني ctDNA. مستويات وجود هذا الحمض النووي السرطاني الدوراني ctDNA عند الأصحاء يكون بنسب قليلة ويصبح أعلى عند مرضى السرطان. ربما يحدث هذا بسبب عدم كفاءة اختراق الخلايا المناعية مناطق الورم الذي بدوره يقلل فعالية إزالة هذا الحمض النووي السرطاني من المجرى الدموي.
الوسائل
اعتبارات ما قبل التحليل
عندما يتم جمع الدم في أنابيب EDTA وتخزينها تبدأ خلايا الدم البيضاء بالتحلل وتحرير حمض نووي من النوع البري في العينة بكميات عادةً ما تكون أضعاف الكمية العادية في حالة وجود الحمض النووي السرطاني الدوراني ctDNA وهذا يجعل الكشف عن الطفرات أو المؤشرات الحيوية الأخرى لctDNA أكثر صعوبة. باستخدام أنابيب حفظ الخلايا (وهي متاحة تجاريا) يمكن أن نمنع أو نؤخر تحلل الخلايا البيضاء وبالتالي التقليل من تأثيرها على الحمض النووي السرطاني الدوراني ctDNA. أظهرت التقنية ما قبل التحليلية المحسنة "Sherwood et al” اكتشافاً مبهراً لطفرات KARS (وهو اختصاراً لإنزيم ليزيل الحمض النووي الريبوزي الناقل lysyl-tRNA synthetase المشفَّر بالمورثة KARS) في عينات متطابقة تم جمعها في أنابيب EDTA K3 و Streck BCT. تكمن مزايا أنابيب حفظ الخلايا في حالة عدم القدرة على معالجة الدم الفورية للحصول على بلازما بشكل مباشر. اجراءات أخرى يمكنها تقليل حدوث "تلوث" الحمض النووي البري وتجعل الكشف عن الحمض النووي السرطاني الدوراني ctDNA أسهل مثل:
- لا تجمد أبداً أي عينة دموية قبل استخلاص البلازما منها من أجل إجراء تحليل الحمض النووي السرطاني الدوراني ctDNA.
- أن تكون معالجة العينة الدموية لاستخلاص البلازما خلال 2-4 ساعات (في حال تم جمع العينة في أبنوب EDTA)
- لا تستخدم أبداً أنابيب الهيبارين، يمنع الهيبارين حدوث تفاعل البوليمراز المتسلسل PCR عن طريق محاكاة البنية الحلزونية للحمض النووي الريبي منقوص الأوكسجين DNA.
- قم بإدخال أنابيب العينات الدموية في جهاز الطرد المركزي (يقوم جهاز الطرد المركزي بفصل البلازما ثم تكرر العملية على البلازما لإزالة البقايا من أسفل الأنبوب) وذلك لإزالة البقايا الخلوية قبل استخلاص الحمض النووي.
- البلازما أفضل من السيروم في استعادة الحمض النووي السرطاني الدوراني ctDNA.
استخلاص الحمض النووي السرطاني الدوراني ctDNA
الميزة الأساسية من تحليل الحمض النووي السرطاني الدوراني ctDNA هو أنه يتم استخلاصه بطرق غير جائرة بل عن طريق سحب الدم. للحصول على الحمض النووي عديم الخلية cfDNA أو الحمض النووي السرطاني الدوراني ctDNA يتطلب ذلك سحب تقريبا 3مل من الدم في أنابيب ملفحة بثنائي أمين الإثيلين رباعي حمض الأستيك أو اختصاراً EDTA. استخدام حمض EDTA مهم جدا لتقليل حدوث تجلط دموي. يمكن فصل أجزاء البلازما والمصل من الدم من خلال جهاز الطرد المركزي ومنهم يستخلص لاحقاً الحمض النووي عديم الخلية cfDNA والحمض النووي السرطاني الدوراني ctDNA. على الرغم من احتواء المصل على نسب أعلى من الحمض النووي عديم الخلية cfDNA إلا أن ذلك يُعزى للحمض النووي من الخلايا اللمفاوية لذا يُعَد وجود الحمض النووي عديم الخلية cfDNA الملوث سلبياً، وذلك لأنه يقلل من حساسية الكشف عن الحمض النووي السرطاني الدوراني ctDNA ولذلك معظم الدراسات تستخدم البلازما لعزل الحمض النووي السرطاني الدوراني ctDNA. يتم معالجة البلازما بعد ذلك بالطرد المركزي لإزالة بقايا الخلايا الدموية السليمة. تستخدم تقنية التثفل لاستخلاص الحمض النووي السرطاني الدوراني ctDNA وذلك متاح عن طريق مجموعة ادوات مخصصة لذلك ومتوفرة تجارياً.
تحليل الحمض النووي السرطاني الدوراني ctDNA
يتطلب تحليل الحمض النووي السرطاني الدوراني ctDNA بعد استخلاصه استخدام طرق التضخيم والتسلسل المتنوعة. هذه الوسائل مقسمة لمجموعتين رئيسيتين بناءً على ما إذا كان الغرض من إجراء التحليل هو فحص المورثات بدون هدف معين أو بغرض مراقبة مورثات معينة وطفرات معينة لهدف معين.
نهج التحليل غير الموجَّه
قد يكون من الضروري تتبع النهج التسلسلي لكامل الشريط الوراثي أو لكامل شريط الإكسوم (جمع exons بمعنى الخوارج ويقابلها introns بمعنى الدواخل والexons هي التي تبقى في الحمض النووي الريبي المستنسخ tRNA بعد ازالة الدواخل عليه لتشفير تصنيع بروتين معين باختصار الاكسوم هو جزء من الحمض النووي المكون من الخوارج فقط) لاكتشاف الطفرات الجديدة التي ستطرأ على الحمض النووي السرطاني أثناء مراقبة سير المرض أو مقاومته للأدوية. يعتبر نهج التحليل غير الموجَّه مفيد أيضاً في الأبحاث لمراقبة عدم تجانس الأورام أو اكتشاف أهداف دوائية جديدة ومع ذلك، على الرغم من أن هذا النهج قد يكون ضرورياً في تطبيقات معينة إلا أنه أكثر كلفةً وأقل دقةً مما يجعل تحديد الطفرات النادة أكثر صعوبةً أو في حالات يكون فيها مستوى الحمض النووي السرطاني الدوراني ctDNA منخفضاً (وذلك عند وجود المرض وبقاياه في حدودهم الدنيا). علاوة على ذلك، يمكن أن تحدث مشاكل في التمييز بين الحمض النووي من الخلايا السرطانية والحمض النووي من الخلايا الطبيعية باستخدام نهج تحليل الشريط الوراثي بأكمله.
عادة ما يستخدم تسلسل الشريط الوراثي كاملاً أو شريط الإكسوم كاملاً تقنيات تسلسل حمض نووي عالية الإنتاجية. الاقتصار على تسلسل الإكسوم كاملاً فقط يمكن أن يقلل من التكلفة ويزيد من سرعة العمل لكن هذا على حساب فقدان معلومات حول الطفرات في المناطق المنتظمة غير المشفرة من الحمض النووي. في حين أن الاكتفاء بمجرد النظر إلى أشكال الحمض النووي من خلال التسلسل لا يفرق بين الحمض النووي الخاص بالسرطان أو الخلايا الطبيعية إلا أن هذه المشكلة يمكن حلها بالمقارنة مع عينة مضبوطة من الحمض النووي الطبيعي (على سبيل المثال، حمض نووي مستخلص من مسحة فموية). الأهم من ذلك، فإن تسلسل الشريط الوراثي كاملاً أو الإكسوم كاملاً مفيد في اكتشاف الطفرات الأولية. يوفر هذا معلومات لاستخدام تقنيات ذات هدف معين وأكثر حساسية ويمكن استخدامها لمراقبة الأمراض.
علم الكروموسومات الرقمي
على عكس علم الكروموسومات العادي الذي يقوم بوضع صبغة لوسم حزم الكروموسومات من أجل جعلها مرئية فإن علم الكروموسومات الرقمي يستخدم تسلسل الحمض النووي في موقع محدد من طول الشريط الوراثي لإحصاء CNV أو ما يعرف بتعدد رقم النسخ. تعدد رقم النسخ شائع في السرطانات ويصف الحالات عندما يكون فقدان الأليل لمورثة معينة (تغاير الأليل) مؤدياً إلى نقص في الأداء الوظيفي لهذه المورثة بسبب التعبير المورثي الناقص أو قد يؤدي إلى تضاعف المورثة الذي يصاحب مبالغة في التعبير الوراثي.
التحليل الذاتي للنهايات المُعاد ترتيبها أو PARE
بعد إجراء التسلسل لشريط وراثي كامل باستخدام طريقة تسلسل ذات انتاجية عالية مثل Illumina HiSeq، يتم تطبيق تقنية PARE على البيانات الموجودة لتحليل كيفية إعادة ترتيب الكروموسومات وتغير مواقعها. هذه التقنية صُممت في الأساس لتحليل الحمض النووي السرطاني الحقيقي وتم تعديلها من أجل تطبيقات الحمض النووي السرطاني الدوراني ctDNA.
مثيلة الحمض النووي الريبوزي منقوص الأكسجين DNA وهيدوكسي المثيلة
مثيلة الحمض النووي أي هو إجراء عملية مثيلة (إضافة مجموعة ميثيل) إلى حمض نووي ريبوزي منقوص الأكسجين بهدف تغيير الشكل البنائي له، وذلك بغرض العلاج الكيميائي من مرض السرطان.* يعد التشفير المورثي التخلقي المناسب ضرورياً للتعبير الوراثي الطبيعي ولوظائف الخلية والتغيرات الشاذة في الأنماط الغير وراثية وهي السمة المميزة للسرطان. يتم الحفاظ على الوضع المورثي التخلقي الطبيعي (الحالة الوراثية) في خلية ما جزئياً على الأقل من خلال مثيلة الحمض النووي. من الممكن قياس انماط شاذة من الحمض النووي السرطاني الدوراني ctDNA بعد مقارنته مع مثيلة مستقرة في مناطق معينة من الحمض النووي يُشار لها باسم (جزر CPG) وهي مناطق من الحمض النووي حيث تتبع نيوكليوتيدات السيتوزين نيوكليوتيدات الجوانين في التسلسل الخطي للقواعد الوراثية على طول الإتجاه من 5'-3'
يمكن تحديد مثيلة الحمض النووي السرطاني الدوراني ctDNA من خلال «معالجة البيسولفيت». «معالجة البيسولفيت» تحول كيميائياً السيتوزينات غير المثيلة إلى يوراسيل ولا تُعدل على السيتوزينات المثيلة. بعد ذلك، يتم سلسلة الحمض النووي وأي تغيرات تطرأ على مسار مثيلة الحمض النووي يمكن تحديده. هيدوكسي مثيلة الحمض النووي أيضا يقوم بتأشير مشابه وقد أظهر على أنه قد يكون علامة تنبوئية للحالات الصحية مقابل الحالات المرضية في الحمض النووي عديم الخلية cfDNA ومن ضمنها مرض السرطان.
نهج التحليل الموجَّه
في هذا النهج، يمكن توجيه سلسلة الحمض النووي السرطاني الدوراني ctDNA بإتجاه مسار وراثي مبني على مواقع طفرية معينة يحدث بها السرطان غالباً. وهذا مهم جداً من أجل صنع علاج في الحالات التي تكون فيها الطفرات محددة وقابلة للعلاج الدوائي. التحليل الذاتي الموجه للحمض النووي السرطاني الدوراني ctDNA لكل مريضٍ على حدى أيضاً ممكن وذلك بإجراء مقارنة بين الخزعات السائلة وخزعات الأنسجة الأساسية الطبيعية. إن أجراء سَلسَلة لكامل الشريط الوراثي أو كامل شريط الإكسوم المستخلص من خزعة من ورم بدئي يسمح لنا باكتشاف طفرات جينية معينة ستطرأ على ورم هذا المريض ويمكن استخدامها لاحقاً لإجراء التسلسل الموجَّه للحمض النووي السرطاني الدوراني ctDNA لمريضٍ ما. أعلى مقياس حساسية للكشف عن الحمض النووي السرطاني الدوراني ctDNA يكون من خلال التسلسل الموجَّه النوعي لتعدد أشكال النيوكليوتيدات المفردة أو ما يعرف ب SNPs. المورثات الطافرة عادةً، على سبيل المثال المورثات المسرطنة أي تحوي مناطق أكثر قابلية لحدوث الطفرات تكون مرجحة أكثر لإجراء نهج التسلسل الموجَّه عليها.
والعكس صحيح، فمعظم الجينات الكابحة للورم أي غير مؤهبة لحدوث الطفرات فيها على كامل طول المورثة فهي غير مناسبة لإجراء نهج التسلسل الموجَّه عليها. هذا النهج الموجَّه لديه ميزة تضخيم الحمض النووي السرطاني الدوراني ctDNA من خلال تفاعل تسلسل البوليميراز PCR العادي والرقمي. وهذا مهم جدا خاصة عندما يكون إجراء تحليل الحمض النووي السرطاني الدوراني ctDNA ليس فقط بسبب وجود مستويات منخفضة نسبياً في المجرى الدموي وإنما أيضاً لأنه يُشكل نسبة قليلة من إجمالي الحمض النووي عديم الخلية cfDNA المستخلص. ولذلك فإن تضخيم المناطق المؤهبة للسرطان يحسن بشكل جذري مقياس حساسية الكشف عن الحمض النووي السرطاني الدوراني ctDNA. ومع ذلك، التضخيم بواسطة PCR يمكن أن يعطي أخطاءً ويزيد من نسبة الأخطاء الكامنة أساساً في بولميرات الحمض النووي. الأخطاء التي تحدث أثناء السلسلة أيضاً تقلل من مقياس حساسية الكشف عن طفرات في الحمض النووي السرطاني الدوراني ctDNA.
المراجع
| التصنيفات الطبية |
|---|