العلاج البكتيري هو علاج يستخدم للبكتيريا لعلاج الأمراض. العلاجات البكتيرية هي أدوية حية ، وقد تكون بكتيريا من النوع البري (غالبًا على شكل بروبيوتيك ) أو بكتيريا التي تمت هندستها وراثيا لمعالجة الخصائص التي يتم حقنها في المريض. الأمثلة الأخرى للأدوية حية تشمل العلاجات الخلوية (بما في ذلك العلاج المناعي ) وعلاجات الملتهمة .
تطوير العلاجات البكتيرية
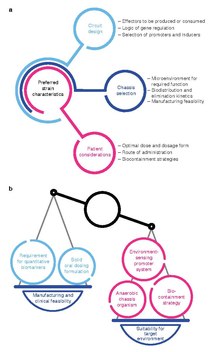
(أ) عدة جوانب تتطلب النظر أثناء تصميم العلاج الذي تم هندسه بالبكتيريا. يمكن توجيه عملية اختيار هيكل لكائن الحي من خلال موقع النشاط المطلوب وخصائص الحرائك الدوائية للهيكل ، إضافة إلى جدوى التصنيع. قد يتأثر تصميم الدوائر الجينية أيضًا بمؤثرات الدائرة ، والمخاوف عملية متعلقة بالمركبات المحفزة ، والاستقرار الجيني للدوائر التنظيمية. بشكل حاسم ، قد يتم أيضًا تقييد تصميم دواء بكتيري مُعدّل هندسيًا بسبب اعتبارات تتعلق باحتياجات المرضى.
(ب ) يتطلب تصميم الإجهاد الأمثل غالبًا توازنًا بين ملاءمة الإتزان للوظيفة في البيئة الدقيقة المستهدفة والمخاوف المتعلقة بجدوى التصنيع والتطوير السريري.
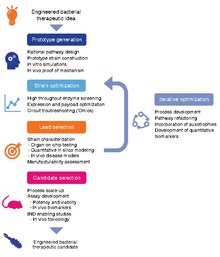
تمثيل تخطيطي لسير العمل لتطوير سلالات مهندسة بجودة المرشح السريري. يجب على تطوير العمل لتحسين فاعلية تقنيات الأجهاد ، بالإضافة إلى فحوصات التنبؤية في المختبر وفي الجسم الحي ، بالإضافة إلى نوع الكمي لنماذج علم الأدوية ، أعظم إمكانة الترجمة لمجموعات المرضى.
يعد تطوير العلاجات البكتيرية مجال بحث نشط للغاية في مجالات البيولوجيا التركيبية وعلم الأحياء الدقيقة.في الوقت الحالي ، هناك تركيز كبير على: تحديد البكتيريا التي تنتج تأثيرات علاجية بشكل طبيعي (على سبيل المثال ، بكتيريا بروبيوتيك) ، و 2) برمجة البكتيريا وراثيًا لإنتاج تأثيرات علاجية.
التطبيقات
علاج السرطان
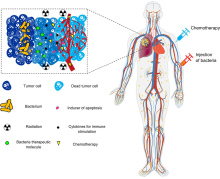
رسم تخطيطي لاستراتيجيات البكتيريا العلاجية ضد أورام نقص التأكسج
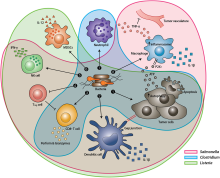
بعد الإدارة الجهاز ، يتم توطين البكتيريا في البيئة المكروية للورم. التفاعلات بين البكتيريا والخلايا السرطانية والبيئة المكروية المحيطة بها تسبب تغييرات مختلفة في الخلايا المناعية المتسللة إلى الورم ، والسيتوكينات ، والكيموكينات ، مما يسهل أيضًا انحدار الورم. يمكن للسموم البكتيرية من سلمونيلات التيفيموريوم و الليستيريا و كلوستريديوم أن تقتل الخلايا السرطانية مباشرة عن طريق إحداث موت الخلايا المبرمج أو الالتهام الذاتي. يمكن للسموم التي يتم توصيلها عن طريق السالمونيلا تنظيم كونيكسين 43 (Cx43) ، مما يؤدي إلى تقاطعات فجوة تسببها البكتيريا بين الورم والخلايا الجذعية ، التي تسمح بعرض مستضدات الورم على الخلايا الجذعية. ② عند التعرض لمستضدات الورم والتفاعل مع المكونات البكتيرية ، تفرز الخلايا الجذعية كميات قوية من المحفز للالتهابات سيتوكين ، والذي ينشط لاحقًا خلايا مجموعة التمايز 8+ الخلايا التائية . ③ يتم تعزيز الاستجابة المضادة للورم لخلايا مجموعة التمايز 8+ الخلايا التائية المنشطة بواسطة فلاجيلين البكتيري (وحدة فرعية بروتينية في السوط البكتيري) عبر تنشيط مستقبلات تشبه الرقم 5. تقتل بروتينات البيرفورين و غرانزيم التي تفرزها خلايا مجموعة التمايز 8+ الخلايا التائية المنشطة بكفاءة الخلايا السرطانية في الأورام الأولية والنقيلة. ④ تقلل إشارات فلاجيلين و مستقبلات تشبه الرقم 5 أيضًا من وفرة الخلايا التائية التنظيمية مجموعة التمايز 25 + مجموعة التمايز 4 ، مما يؤدي لاحقًا إلى تحسين الاستجابة المضادة للورم لخلايا مجموعة التمايز 8 + الخلايا التائية المنشطة. ⑤ سلمونيلات التيفيموريوم فلاجيلين يحفز الخلايا القاتلة الطبيعية لإنتاج إنتَرْفيرونُ ، وهو سيتوكين مهم لكل من المناعة الفطرية والتكيفية. ⑥ تتحول الخلايا الكابتة المشتقة من النخاع الشوكي المصابة بالليستريا إلى نمط ظاهري محفز للمناعة يتميز بزيادة إنتاج 1 لتر 12 ، مما يعزز استجابات خلايا مجموعة التمايز 8+ الخلايا التائية و القاتل الطبيعي. ⑦ يمكن لكل من عدوى سلمونيلات التيفيموريوم و كلوستريديوم أن تحفز تراكم العدلات بشكل كبير. إن زيادة إفراز ليجند و عامل نخر الورم المرتبط بموت الخلايا المبرمج (عامل نخر الورم المرتبط بالاستماتة يحفز يجند) بواسطة العدلات يعزز الاستجابة المناعية ويقتل الخلايا السرطانية عن طريق إحداث موت الخلايا المبرمج. ⑧ يتم تنشيط جسيم البلاعم الملتهب من خلال ملامسة المكونات البكتيرية (LPS و فلاجيلين) والخلايا السرطانية المتضررة من السالمونيلا ، مما يؤدي إلى زيادة إفراز أل - 1 بيتا و عامل نخر الورم في البيئة الدقيقة للورم. خلية NK: خلية قاتلة طبيعية. خلية تريجية: خلية تائية تنظيمية. MDSCs: الخلايا الكابتة المشتقة من النخاع الشوكي. مستقبل P2X7: مستقبلات بيورينوسبتور 7 خارج الخلية الأدينوسين ثلاثي الفوسفات . LPS: عديد السكاريد الدهني

البكتيريا المسببه السرطان وعلاجه
ناك اهتمام كبير باستخدام البكتيريا كعلاج لعلاج الأورام. على وجه الخصوص ، تعد البكتيريا الموجهة للورم التي تنمو في البيئات قليلة التأكسج جذابة بشكل خاص لهذا الغرض ، لأنها تميل إلى الهجرة و الغزو(من خلال الأوعية الدموية المتسربة في البيئة الدقيقة والورام) واستعمار الأورام. تميل هذه الخاصية إلى زيادة وقت بقائهم في الورم ، مما يمنحهم وقتًا أطول لممارسة آثارهم العلاجية ، على عكس البكتيريا الأخرى التي يمكن أن يتخلص منها الجهاز المناعي بسرعة.
هندسة الميكروبيوم
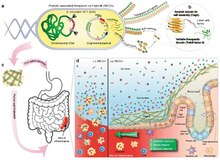
البروبيوتيك المعدلة وراثيًا كأدوية حية لعلاج التهاب الأمعاء
هناك اهتمام كبير باستخدام العلاجات البكتيرية لتغيير الجراثيم المعوية البشرية ، والتي من شأنها أن تكون مفيدة في علاج أمراض مثل فرط نمو البكتيريا المعوية الدقيقة وأشكال أخرى من دسباقتريوز .
المراجع






