
جهاز مناعي
| هذه المقالة تخضع حاليًّا لمرحلة مراجعة الزملاء لفحصها وتقييمها، تحضيرًا لترشيحها لتكون ضمن المحتوى المتميز في ويكيبيديا العربية. تاريخ بداية المراجعة 27 مارس 2023 |
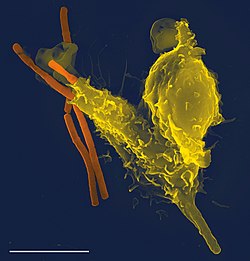
الجهاز المناعي هو شبكة من العمليات الحيوية التي تحمي الكائن الحي من الأمراض. يكتشف ويستجيب لمجموعة واسعة من مُسببات الأمراض، من الفيروسات إلى الديدان الطفيلية، وكذلك الخلايا السرطانية، ويميزها عن الأنسجة السليمة للكائن الحي. العديد من الكائنات الحية لديها نظامين فرعيين رئيسيين من الجهاز المناعي. يوفر الجهاز المناعي الفطري استجابة مسبقة التكوين لمجموعات واسعة من الحالات والمحفزات. ويوفر جهاز المناعة التكيفي استجابة مصممة لكل منبه من خلال تعلم التعرف على الجزيئات التي صادفها من قبل. كلاهما يستخدم الجُزيئات والخلايا لأداء وظائفها.
تمتلك جميع الكائنات الحية تقريبًا نوعًا من جهاز المناعة. البكتيريا لديها جهاز مناعة أولي على شكل إنزيمات تحمي من عدوى الفيروسات. تطورت آليات المناعة الأساسية الأخرى في النباتات والحيوانات القديمة ولا تزال في أحفادها الحديثة. وتشمل هذه الآليات البلعمة، ببتيدات مضادة للميكروبات تُسمى ديفنسين، والنظام المتمم. تمتلك الفقاريات ذوات الفك، بما في ذلك البشر، آليات دفاعية أكثر تطورًا، بما في ذلك القدرة على التكيف للتعرف على مسببات الأمراض تعرفًا أكثر كفاءة. تخلق المناعة التكيفية (أو المكتسبة) ذاكرة مناعية تؤدي إلى استجابة معززة لمواجهة لاحقة مع الممراض نفسه. عملية اكتساب المناعة هذه هي أساس التطعيم.
يُمكن أن يتسبب خلل في الجهاز المناعي في أمراض المناعة الذاتية والأمراض الالتهابية والسرطان. يحدث نقص المناعة عندما يكون الجهاز المناعي أقل نشاطًا من المعتاد، مما يؤدي إلى عدوى متكررة ومهددة للحياة. في البشر، يُمكن أن يكون نقص المناعة نتيجة لمرض وراثي مثل نقص المناعة المشترك الحاد، أو حالات مكتسبة مثل فيروس العوز المناعي البشري/الإيدز، أو استخدام الأدوية المثبطة للمناعة. تنتج المناعة الذاتية من جهاز مناعي مفرط النشاط يهاجم الأنسجة الطبيعية كما لو كانت كائنات حية غريبة. تشمل أمراض المناعة الذاتية الشائعة التهاب الغدة الدرقية لهاشيموتو والتهاب المفاصل الروماتويدي ومرض السكري النوع الأول، والذئبة الحمامية الشاملة. يغطي علم المناعة دراسة جميع جوانب الجهاز المناعي.
دفاع متعدد الطبقات
يحمي نظام المناعة مضيفه من الإصابة بالأمراض بواسطة عدد من خطوط الدفاع التي يزداد تخصصها بعد كل خط. تمنع الحواجز البدنية مثل الجلد الكائنات الممرضة مثل البكتيريا والفيروسات من الدخول إلى الكائن الحي. وإذا تمكن الممراض من اختراق هذه الحواجز يستجيب جهاز المناعة الفطري استجابة فورية لكنها غير متخصصة. تتواجد أنظمة المناعة الفطرية لدى جميع الحيوانات، وإذا تمكن الممراض من تجنب الاستجابة المناعية الفطرية بنجاح فإن الفقاريات تملك خطا ثانيا من الحماية هو جهاز المناعة التكيفي الذي يُنشّط بواسطة استجابة المناعة الفطرية. وعندها يُكيِّف جهاز المناعة استجابته في أثناء الإصابة لتحسين التعرف على الممراض، وبعد القضاء على هذا الأخير يحتفظ بهذه الاستجابة المحسنة على هيئة ذاكرة مناعية تسمح لجهاز المناعة التكيفي بالاستجابة على نحو أسرع وأقوى في المرات القادمة التي يواجه فيها الممراض نفسه.
| جهاز المناعة الفطري | جهاز المناعة التكيفي |
|---|---|
| استجابة غير متخصصة | استجابة متخصصة للمستضدات والممراضات |
| التعرض للإصابة يؤدي إلى استجابة فورية وقصوى | الاستجابة القصوى تستغرق وقتا بعد التعرض للإصابة |
| مناعة خلوية ومكونات المناعة الخلطية | مناعة خلوية ومكونات المناعة الخلطية |
| لا توجد ذاكرة مناعية | التعرض للإصابة يؤدي إلى ذاكرة مناعية |
| توجد لدى جميع أشكال الحياة تقريبا | توجد لدى الفقاريات الفكية فقط |
تعتمد كلا المناعتان الفطرية والتكيفية على قدرة جهاز المناعة على التمييز بين الجزيئات الذاتية وغير الذاتية. في علم المناعة، الجزيئات الذاتية هي جزيئات من مكونات جسم الكائن ويمكن تمييزها عن المواد الغريبة بواسطة جهاز المناعة. وبالعكس الجزيئات غير الذاتية هي جزيئات ليست من مكونات الجسم ويُتعرَّ عليها بأنها جزيئات غريبة. أحد أقسام الجزيئات غير الذاتية هو المستضدات (سميت كذلك لأنها تتسبب في توليد الأجسام المضادة) وتُعرف على أنها مواد ترتبط بمستقبلات مناعية خاصة وتثير استجابة مناعية.
أعضاء المناعة في الإنسان
أعضاء مناعية أولية وتمثل المكان الذي نشأت أو نضجت فيه الخلايا المناعية وتشمل:
أعضاء مناعية ثانوية هي المكان الذي تتواجد فيه الخلايا المناعية بعد أن انتقلت من الأعضاء المناعية الأولية وتمثل المكان الذي ستواجه فيها الخلايا المناعية الأنتجين لاحداث استجابة مناعية وتشمل:
- الأغشية المخاطية التي تبطن الممرات الداخلية في الفم، مريء، المعدة، الأمعاء، المثانة، الحالب.
- العقد اللمفاوية
- الطحال
- اللوزتين
الحواجز السطحية
تحمي حواجز عديدة الكائنات من الإصابة بالممراضات ومنها: الحواجز الميكانيكية والكيميائية والبيولوجية. الإهاب الشمعي لمعظم الأوراق، الهيكل الخارجي الخاص بالحشرات، أغشية وقشور البيوض المودعة خارجيا، والجلد هي أمثلة عن الحواجز الميكانيكية التي تعتبر خط الدفاع الأول ضد الإصابة. لا يمكن للكائنات الانغلاق كليا عن بيئاتها الخارجية، لذلك توجد آليات تعمل على حماية فتحات الجسم مثل الرئتين والأمعاء والجهاز البولي التناسلي. يُخرج السعال والعطاس الممراضات ميكانيكيا من الرئتين وكذلك تفعل حالات التهييج الأخرى التي تحدث في السبيل التنفسي. تطرح وظيفة الصرف الخاصة بالدموع والبول الممراضات خارجا، ويعمل المخاط الذي يفرزه السبيل التنفسي والقناة الهضمية كمصيدة لحجز الكائنات الدقيقة.
تحمي الحواجز الكيميائية ضد الإصابة بالممراضات كذلك، إذ يفرز الجلد والسبيل التنفسي ببتيدات مضادة للميكروبات مثل: β-ديفنسين. الإنزيمات مثل الليزوزيم والفسفو ليباز A2 في اللعاب والدموع وحليب الأم هي مضادات للجراثيم كذلك. تعمل الإفرازات المهبلية كحاجز كيميائي بعد بدء الإحاضة حين تصبح حمضية قليلا، ويحتوي المني على الديفنسينات والزنك للقضاء على الممراضات. يعمل الحمض المعدي في المعدة كدفاع كيميائي ضد الممراضات المبتلَعة.
يعمل النبيت المُطاعم داخل الجهاز البولي والتناسلي والقناة الهضمية بصفته حاجزاً حيوياً من خلال التنافس مع البكتيريا الممرضة على الطعام والمكان، ويُغيِر في بعضٍ من الأحيان الظروف في بيئته مثل الأس الهيدروجيني والحديد المتوفر ونتيجة لذلك تنقص احتمالية بلوغ الممراضات أعدادا كافية قادرة على التسبب في المرض.
الجهاز المناعي الفطري
تواجه الكائنات الدقيقة أو الذيفانات التي تنجح في الدخول إلى الكائن الحي خلايا وآليات الجهاز المناعي الفطري. وتبدأ الاستجابة الفطرية عادةً عندما تُحدد الأحياء الدقيقة بواسطة مستقبلات التعرف على الأنماط، التي تتعرف على المكونات المحفوظة بين مجموعات واسعة من الكائنات الدقيقة، أو عندما ترسل الخلايا التالفة أو المصابة أو المجهدة إشارات إنذار، تتعرف على الكثير منها نفس المستقبلات التي تتعرف على مسببات الأمراض. الدفاعات المناعية الفطرية غير متخصصة، ما يعني أن هذه الأنظمة تستجيب لمسببات الأمراض بطريقة عامة. هذا النظام لا يمنح مناعة طويلة الأمد ضد مسببات الأمراض. جهاز المناعي الفطري هو النظام المهيمن للدفاع عن المضيف في معظم الكائنات الحية، وهو الجهاز الوحيد في النباتات.
الاستشعار المناعي

تستخدم الخلايا في الجهاز المناعي الفطري مستقبلات التعرف على الأنماط للتعرف على التراكيب الجزيئية التي تنتجها مسببات الأمراض. وهي بروتينات يُعبّر عنها أساسًا، بواسطة خلايا الجهاز المناعي الفطري، مثل الخلايا المتغصِّنة والخلايا البلعمية والخلايا الوحيدة والكريات العدلة الطبيعية والخلايا الظهارية، لتحديد فئتين من الجزيئات: الأنماط الجزيئية المرتبطة بمسببات الأمراض (PAMPs)، التي ترتبط بمسببات الأمراض الميكروبية، والأنماط الجزيئية المرتبطة بالضرر (DAMPs)، التي ترتبط بمكونات خلايا المُضيف التي تُطلَق في أثناء تلف الخلايا أو موتها.
تُعرف الأنماط الجزيئية المرتبطة بمسببات الأمراض خارج الخلوية أو الداخلية عن طريق بروتينات عبر غشائية تعرف باسم المستقبلات الشبيهة بالتول (TLRs). تتشارك المستقبلات الشبيهة بالتول في نمط هيكلي نموذجي، وهو التكرار الغني باللوسين (LRRs)، الذي يعطيها شكلاً منحنيًا. اكتُشفت المستقبلات الشبيهة بالتول لأول مرة في ذبابة الفاكهة الشائعة وتحفز تركيب وإفراز السيتوكينات وتنشيط برامج دفاع المضيف الأخرى الضرورية لكل من الاستجابات المناعية الفطرية أو التكيفية. وقد وُصفت عشر مستقبلات شبيهة بالتول في البشر.
تحتوي خلايا الجهاز المناعي الفطري على مستقبلات التعرف على الأنماط، والتي تكتشف العدوى أو تلف الخلايا الداخِلِيّة. وهناك ثلاث فئات رئيسية من هذه المستقبلات «العصارية الخلوية» هي: المستقبلات الشبيهة بنود، والمستقبلات الشبيهة بريغ، ومستشعرات الدنا العصارية الخلوية.
الخلايا الفطرية المناعية

تعمل بعض الكريات البيضاء (خلايا الدم البيضاء) مثل كائنات مستقلة وحيدة الخلية وهي الذراع الثاني للجهاز المناعي الفطري. تشمل الكريات البيضاء الفطرية الخلايا البلعمية «المحترفة» (البلعميات الكبيرة، والعدلات، والخلايا التغصنية). تحدد هذه الخلايا مسببات الأمراض وتعمل على القضاء عليها، إما عن طريق مهاجمة مسببات الأمراض كبيرة الحجم من خلال الاتصال أو عن طريق ابتلاع الكائنات الحية الدقيقة ثم قتلها. تشمل الخلايا الأخرى التي تشارك في الاستجابة الفطرية الخلايا الليمفاوية الفطرية والخلايا البدينة والخلايا الحمضية، والخلايا القاعدية والخلايا القاتلة الطبيعية.
البلعمة هي إحدى السمات المهمة في المناعة الفطرية الخلوية التي تؤديها الخلايا البلعمية عندما تبتلع مسببات الأمراض أو الجسيمات. تتحرك الخلايا البلعمية عمومًا في ما يُشبه الدوريات في الجسم بحثًا عن مسببات الأمراض، ولكن يمكن للسيتوكينات استدعاؤها إلى مواقع محددة. بمجرد أن تبتلع الخلية البلعمية مسبب المرض، فإنه يصبح محاصرًا في حويصلة داخل خلوية تُسمى الجسيم البلعمي والتي تندمج فيما بعد مع حويصلة أخرى تُسمى اليَحلُول لتكوين الجسيم الحال البعلمي. يُقتل مسبب المرض بسبب نشاط إنزيمات الهضم أو بعد الهبة التنفسية التي تطلق الجذور الحرة في الجسيم الحال البعلمي. تطورت البلعمة كوسيلة للحصول على العناصر الغذائية، ولكن هذا الدور توسع في الخلايا البلعمية ليشمل ابتلاع مسببات الأمراض كآلية دفاعية. وربما تمثل البلعمة أقدم شكل من أشكال دفاع المُضِيف وذلك لتواجد البلعميات في كل من الحيوانات الفقارية واللافقارية.
الكريات العدلة الطبيعية والبَلعميات الكبيرة هي خلايا بلعمية تنتقل في جميع أنحاء الجسم بحثًا عن مسببات الأمراض الغازية. تتواجد الكريات العدلة الطبيعية عادةً في مجرى الدم وهي أكثر أنواع الخلايا البلعمية وفرة، فهي تُمثِّل 50% إلى 60% من إجمالي الكريات البيضاء المنتشرة. خلال المرحلة الحادة من الالتهاب، تهاجر الكريات العدلة الطبيعية نحو موقع الالتهاب في عملية تسمى الانجذاب الكيميائي، وعادةً ما تكون الخلايا الأولى التي تصل إلى مكان الإصابة. الخلايا البلعمية الكبيرة هي خلايا متعددة الاستعمالات توجد داخل الأنسجة وتنتج مجموعة من المواد الكيميائية بما في ذلك الإنزيمات والبروتينات المكملة والسيتوكينات، في حين يمكنها أيضًا أن تعمل كقمامات (منظفات) تخلص الجسم من الخلايا الميتة وغيرها من الأنسجة الخلوية، وتعمل كذلك كخلايا مقدمة للمستضد (APCs) تنشط الجهاز المناعي التكيفي.
الخلايا التغصنية هي خلايا بلعمية تكون في الأنسجة التي تتلامس مع البيئة الخارجية؛ ولذلك، فإنها توجد أساسًا في الجلد والأنف والرئتين والمعدة والأمعاء. سُميت بهذا الاسم بسبب تشابهها مع التغصنات العصبية، فكلاهما لديه العديد من النتوآت الشبيهة بالعمود الفقري. الخلايا التغصنية هي حلقة الوصل بين أنسجة الجسم والجهاز المناعي الفطري والتكيفي، لأنها تقدم مولدات ضد للخلايا التائية، وهي أحد أنواع الخلايا الرئيسية في جهاز المناعة التكيفي.
الخلايا المُحببة هي كريات الدم البيضاء التي تحتوي على حبيبات في السيتوبلازم. توجد في هذه المجموعة الكريات العدلة الطبيعية والخلايا البدينة وخلايا الدم البيضاء القاعدية والخلايا الحمضية. تتواجد الخلايا البدينة في الأنسجة الضامة والأغشية المخاطية، وتنظِّم الاستجابة الالتهابية. وهي ترتبط في أغلب الأحيان بالحساسية وصدمة الحساسية. ترتبط الكريات البيضاء القاعدية والخلايا الحمضية بالكريات العدلة الطبيعية، وتفرز وسائط كيميائية تساهم في الدفاع ضد الطفيليات وتؤدي دورًا في ردود الفعل التحسسية، مثل الربو.
الخلايا اللمفاوية الفطرية (ILCs) هي مجموعة من الخلايا المناعية الفطرية المشتقة من السلف اللمفاوي المشترك وتنتمي إلى السلالة اللمفاوية. تُعرف هذه الخلايا من خلال عدم وجود مستقبلات الخلايا البائية أو التائية الخاصة بالمستضد (TCR) بسبب عدم وجود جين منشط للتأشيب. لا تُعبِّر الخلايا اللمفاوية الفطرية عن علامات الخلايا النخاعية أو التغصنية.
الخلايا القاتلة الطبيعية (خلايا NK) هي خلايا ليمفاوية وأحد مكونات جهاز المناعة الفطري التي لا تهاجم الميكروبات الغازية مباشرةً. وبدلاً من ذلك، تدمر الخلايا القاتلة الطبيعية خلايا المضيف مختلة الوظيفة مثل الخلايا السرطانية أو الخلايا المصابة بالفيروس، وتتعرف على هذه الخلايا من خلال حالةٍ تعرف باسم «الذات المفقودة». يصف هذا المصطلح خلايا ذات مستويات منخفضة من علامة على سطح الخلية تدعى MHC I (معقد التوافق النسيجي الكبير) -وهي حالة يمكن أن تنشأ في حالات العدوى الفيروسية لخلايا المضيف. خلايا الجسم العادية لا يُتعرَّف عليها ومهاجمتها من قبل الخلايا القاتلة الطبيعية لأنها تعبر عن مستضدات ذاتية سليمة على معقد التوافق النسيجي الكبير. تُعرف مستضدات معقد التوافق النسيجي الكبير هذه بواسطة مستقبلات الغلوبولين المناعي الخاصة بالخلايا القاتلة والتي تكبح وظيفة الخلايا القاتلة الطبيعية عند التعرف على هذه المستضدات الذاتية.
الالتهاب
الالتهاب هو أحد استجابات الجهاز المناعي الأولى للعدوى. أعراض الالتهاب هي الاحمرار والتورم والحرارة والألم، التي تنجم عن زيادة تدفق الدم إلى الأنسجة. يُنتج الالتهاب عن طريق الإيكوزانويدات والسيتوكينات التي تفرزها الخلايا المصابة أو المُعدَاة. تشمل الإيكوزانويدات: البروستاغلاندينات التي تسبب الحمى وتوسع الأوعية الدموية المرتبطة بالالتهاب، واللوكوترايينات التي تجذب بعض خلايا الدم البيضاء (الكريات البيضاء). السيتوكينات الشائعة تشمل الإنترلوكينات المسؤولة عن الاتصال بين خلايا الدم البيضاء؛ الكيموكينات التي تعزز الانجذاب الكيميائي، والإنترفيرونات التي لها تأثيرات مضادة للفيروسات، مثل وقف تصنيع البروتين في الخلية المضيفة. كما يُمكن إطلاق عوامل النمو والعوامل السامة للخلايا. تجند هذه السيتوكينات وغيرها من المواد الكيميائية خلايا مناعية إلى موقع الإصابة وتعزز شفاء أي أنسجة تالفة بعد إزالة مُسببات الأمراض. مستقبلات التعرف على النمط التي تسمى الجسيم الالتهابي هي مركبات متعددة البروتين (تتكون من مستقبل شبيه بنود والبروتين الموائم ASC والجزيء المؤثر سلف كاسباز 1) تتشكل استجابةً للأنماط الجزيئية المرتبطة بمسببات الأمراض والأنماط الجزيئية المرتبطة بالضرر العُصارية الخلوية، وتتمثل وظيفتها في توليد أشكال نشطة من السيتوكينات الالتهابية IL-1β و IL-18.
الدفاعات الخلطية
النظام المتمم هو جزء من جهاز المناعة الفطري ويحتوي على أكثر من 20 بروتينًا مختلفًا، وقد سمي كذلك لقدرته على «إتمام» قتل مسببات الأمراض بعد تجنيد الأجسام المضادة لبروتيناته. النظام المتمم هو مكون خلطي رئيسي في الاستجابة المناعية الفطرية. العديد من الأنواع لديها أنظمة متممة، بما في ذلك غير الثدييات مثل النباتات والأسماك وبعض اللافقاريات. في البشر، تُنشط استجابة النظام المتمم عن طريق ارتباط أحد بروتيناته بالأجسام المضادة المرتبطة بالميكروبات أو عبر ارتباط أحد بروتيناته بالكربوهيدرات على أسطح الميكروبات. تثير إشارة التعرف هذه استجابة سريعة للقتل. تعتمد سرعة الاستجابة على تضخيم الإشارة الذي يحدث بعد التنشيط التحللي المتسلسل لجزيئات الجهاز المتمم، والتي هي بروتيازات بدورها. بعد ارتباط بروتينات الجهاز المتمم في البداية بالكائن الحي الدقيق، وتُنشِّط وظيفة البروتياز الخاص بها، والتي بدورها تنشط بروتيازات أخرى من النظام المتمم، وهكذا. ينتج عن ذلك تحفيز متعاقب يضخم الإشارة الأولية عن طريق التغذية الراجعة الإيجابية المتحكم بها. ينتج عن التحفيز المتعاقب إنتاج ببتيدات تجذب الخلايا المناعية، وتزيد من نفاذية الأوعية الدموية، وتغليف سطح مسببات الأمراض، ووسمها لتدميرها. يمكن لتجنيد النظام المتمم أيضًا أن يقتل الخلايا مباشرةً عن طريق تعطيل عمل غشائها البلازمي.
الجهاز المناعي التكيفي
تطور جهاز المناعة التكيفي في الفقاريات البدائية ويتيح استجابة مناعية أقوى والاحتفاظ بذاكرة مناعية كذلك، «فيُتذكر» كل ممرض بواسطة مستضد مميز. الاستجابة المناعية التكيفية خاصة بالمستضد وتتطلب التعرف على مستضدات «غير ذاتية» محددة خلال عملية تسمى عرض المُستضد. تسمح خصوصية المستضد بتوليد استجابات مصممة خصيصًا لمسببات أمراض معينة أو لخلايا مُصابة بالأمراض. يُحافَظ على قدرة تكوين هذه الاستجابات المخصصة في الجسم عن طريق «خلايا الذاكرة». إذا أصاب أحد مسببات المرض الجسم أكثر من مرة، فإن خلايا الذاكرة المخصصة له تتذكره وتعمل على القضاء عليه بسرعة.
التعرف على المستضدّ
خلايا الجهاز المناعي التكيفي هي أنواع خاصة من الكريات البيضاء، تُسمى الخلايا الليمفاوية. الخلايا البائية والخلايا التائية هما النوعان الرئيسيان من الخلايا الليمفاوية، وهي مُشتَقّة من الخلايا الجذعية المكونة للدم الموجودة في النخاع العظمي. تشارك الخلايا البائية في الاستجابة المناعية الخلطية، في حين تشارك الخلايا التائية في الاستجابة المناعية الخلوية. تتعرف الخلايا التائية القاتلة فقط على المستضدات المقترنة بجزيئات معقد التوافق النسيجي الكبير من الفئة الأولى، في حين تتعرف الخلايا التائية المساعدة والخلايا التائية التنظيمية فقط على المستضدات المقترنة بجزيئات معقد التوافق النسيجي الكبير من الفئة الثانية. تعكس هاتان الآليتان لعرض المستضد الأدوار المختلفة لنوعي الخلايا التائية. وهناك نوع فرعي ثالث ثانوي هو الخلايا التائية غاما دلتا التي تتعرف على المستضدات السليمة غير المرتبطة بمستقبلات معقد التوافق النسيجي الكبير. تتعرض الخلايا التائية مزدوجة الإيجابية لمجموعة واسعة من المستضدات الذاتية في الغدة الصعترية، حيث يكون اليود ضروريًا لنموها ونشاطها في هذه الغدة. في المقابل، المستقبل النوعي للمستضد في الخلية البائية هو جزيء جسم مضاد على سطح الخلية البائية ويتعرف على المستضد الأصلي (الأوَّلِيّ) دون أي حاجة لمعالجة المستضد. قد تكون هذه المستضدات جزيئات كبيرة توجد على أسطح مسببات الأمراض، ولكنها يمكن أن تكون أيضًا هابتينات صغيرة (مثل البنسلين) مُتصلة بجزيء ناقل. تُعبِّر كل سُلاَلَة من الخلايا البائية عن جسم مضاد مختلف، لذلك تمثِّل المجموعة الكاملة من مستقبلات المستضد في الخلايا البائية كل الأجسام المضادة التي يمكن أن يصنعها الجسم. عندما تواجه الخلايا البائية أو التائية المستضدات المرتبطة بها فإنها تتكاثر وتنتج العديد من «نسخ» الخلايا التي تستهدف نفس المستضد. وهذا ما يسمى بالانتقاء النسيلي.
عرض المستضد للخلايا اللمفاوية التائية

تحمل كل من الخلايا البائية والتائية جزيئات مستقبلات تتعرف على أهداف محددة. تتعرف الخلايا التائية على الهدف «غير الذاتي»، مثل مُسبب المرض، فقط بعد معالجة المستضدات (أجزاء صغيرة من مسبب المرض) وعرضها بواسطة مستقبِل «ذاتي» يُدعى جزيء معقد التوافق النسيجي الكبير (MHC).
المناعة الخلوية
هناك نوعان فرعيان رئيسيان من الخلايا التائية: الخلية التائية القاتلة والخلية التائية المساعدة. بالإضافة إلى ذلك هناك الخلايا التائية التنظيمية التي لها دور في تنظيم الاستجابة المناعية.
الخلية التائية القاتلة
الخلايا التائية القاتلة هي مجموعة فرعية من الخلايا التائية التي تقتل الخلايا المصابة بالفيروسات (ومسبِّبات الأمراض الأخرى)، أو التالفة أو التي اختُلَّت وظيفتها. كما هو الحال مع الخلايا البائية، كل نوع من الخلايا التائية يتعرف على مستضد مختلف. تُنشط الخلايا التائية القاتلة عندما ترتبط مستقبلات الخلايا التائية الخاصة بها بهذا المستضد المحدد الذي يكون في معقدٍ مع مستقبلات معقد التوافق النسيجي الكبير من الفئة الأولى في خلية أخرى. يحدث التعرف على معقد معقد التوافق النسيجي الكبير:المستضد بمساعدة مستقبلات مساعدة على لخلية التائية تُسمى كتلة التمايز 8. تنتقل الخلية التائية بعد ذلك في جميع أنحاء الجسم بحثًا عن خلايا تحمل مستقبلات معقد التوافق النسيجي الكبير من الفئة الأولى الخاصة بها هذا المستضد. عندما تتصل الخلية التائية المنشطة بهذه الخلايا فإنها تُطلق سموم خلوية، مثل البيرفورين، ويُشكِّل هذا الأخير مسامَ في الغشاء البلازمي للخلية المستهدفة، ممَّا يسمح بدخول الأيونات والماء والسموم. دخول سمّ آخر يدعى الغرانيوليسين (بروتياز) يدفع الخلية المستهدفة إلى الموت. قتل الخلايا التائية للخلايا المضيفة مهم خصوصاً في منع تكاثر الفيروسات. تنشيط الخلايا التائية منظّمٌ بإحكام ويتطلب عمومًا إشارة تنشيط قوية جدًا من معقد التوافق النسيجي الكبير/المستضد، أو إشارات تنشيط إضافية توفرها الخلايا التائية «المساعدة» (انظر أدناه)
الخلايا التائية المساعدة
تُنظِّم الخلايا التائية المساعدة كل من الاستجابات المناعية الفطرية والتكيفية وتساعد على تحديد الاستجابات المناعية التي يجب أن يُبديها الجسم لمُمرِض معين. هذه الخلايا ليس لها نشاط مسمِّم للخلايا ولا تقتل الخلايا المصابة بالعدوى أو تزيل مسبِّبات الأمراض مباشرةً. بدلًا من ذلك، فإنها تتحكم في الاستجابة المناعية عن طريق توجيه الخلايا الأخرى لأداء هذه المهام.
تُعبّرالخلايا التائية المساعدة عن مستقبلات الخلايا التائية التي تتعرف على المستضد المرتبط بجزيئات معقد التوافق النسيجي الكبير من الفئة الثانية. يُتعرف على معقد معقد التوافق النسيجي الكببر:المستضد أيضًا من قبل مستقبلات CD4 الخاصة بالخلية المساعدة، والتي تجند جزيئات داخل الخلية التائية (مثل Lck ) مسؤولة عن تنشيط الخلية التائية. الخلايا التائية المساعدة لها ارتباط أضعف مع معقد معقد التوافق النسيجي الكبير:المستضد مقارنةً بالخلايا التائية القاتلة، وهذا يعني أن العديد من مستقبلات الخلية التائية المساعدة (قرابة 200-300) يجب أن تكون مرتبطة بمعقد التوافق النسيجي الكبير:المستضد لتنشيط الخلية المساعدة، في حين يمكن تنشيط الخلايا التائية القاتلة عن طريق الارتباط بجزيء واحد من معقد التوافق النسيجي الكبير:المستضد. كما يتطلب تنشيط الخلايا التائية المساعدة مدة أطول من الارتباط مع الخلية المقدمة للمستضد. يؤدي تنشيط الخلية التائية المساعدة في أثناء الراحة إلى إطلاق السيتوكينات التي تؤثر على نشاط العديد من أنواع الخلايا. تعمل إشارات السيتوكين التي تنتجها الخلايا التائية المساعدة على تعزيز وظيفة البلعميات الكبيرة المبيدة للميكروبات ونشاط الخلايا التائية القاتلة. بالإضافة إلى ذلك، يؤدي تنشيط الخلايا التائية المساعدة إلى زيادة تنظيم الجزيئات المعبر عنها على سطح الخلية التائية، مثل ربيطة CD40 (وتسمى أيضا CD154)، التي توفر إشارات تحفيزية إضافية مطلوبة عادةً لتنشيط الخلايا البائية المنتجة للأجسام المضادة.
الخلية التائية غاما دلتا
تمتلك الخلايا التائية غاما دلتا (خلايا تي γδ) مستقبلات خلايا تائية بديلة مختلفة عن CD4+ وCD8+ الخاصة بـالخلايا التائية (αβ)، وتتشارك خصائص خلايا تي المساعدة وخلايا تي السَّامة والخلايا القاتلة الطبيعية. الظروف التي تنتج استجابات من خلايا تي غاما دلتا غير مفهومة تمامًا. مثل غيرها من المجموعات الفرعية للخلايا التائية «غير المألوفة» التي تحمل مستقبلات الخلايا التائية ثابتة، مثل الخلايا التائية القاتلة الطبيعية المحدودة CD1D ، تمتد الخلايا تائية غاما دلتا على الحدود بين المناعة الفطرية والتكيفية. من ناحية، الخلايا التائية غاما دلتا هي مكون من مكونات المناعة التكيفية لأنها تعيد تأشيب جينات مستقبل الخلية التائية لإنتاج تنوعٍ في المستقبلات ويمكن أيضًا أن تطور ذاكرة نمط ظاهري. من ناحية أخرى، فإن المجموعات الفرعية المختلفة هي أيضًا جزء من الجهاز المناعي الفطري، حيث يمكن استخدام مستقبلات الخلايا التائية أو مستقبلات الخلية القاتلة الطبيعية كمستقبلات التعرف على الأنماط. على سبيل المثال، تستجيب أعداد كبيرة من الخلايا التائية البشرية Vγ9 / Vδ2 في غضون ساعات للجزيئات الشائعة التي تنتجها الميكروبات، وتستجيب خلايا التائية Vδ1 + المحدودة جدًا في النسيج الطلائي للخلايا الظهارية المجهدة.
الاستجابة المناعية الخلطية
تُحدد الخلية البائية مسببات الأمراض عندما ترتبط الأجسام المضادة الموجودة على سطحها بمستضد أجنبي معين. تمتص الخلية البائية مركب المستضد/الأجسام المضادة وتعالجه عن طريق تفكيكه إلى ببتيدات. ثم تعرض الخلية البائية هذه الببتيدات المستضدية على جزيئات معقد التوافق النسيجي الكبير من الفئة الثانية على سطحها. تجذب هذه التوليفة بين معقد التوافق النسيجي الكبير والمستضد خلية تائية مساعِدة مطابقة تُطلِق لمفوكينات وتُنشِّط الخلية البائية. عندما تبدأ الخلية البائية المنشَّطة بالانقسام، تفرز أنسالها (خلايا البلازما) ملايين النسخ من الجسم المضاد الذي يتعرف على هذا المستضد. تنتشر هذه الأجسام المضادة في بلازما الدم واللمف، وترتبط بمسببات الأمراض التي تعبر عن المستضد وتسمها من أجل تدميرها عن طريق تنشيط الجهاز المتمم أو عبر امتصاصها وتدميرها بواسطة الخلايا البلعمية. ويمكن للأجسام المضادة أيضًا أن تُبطل مفعول الممراضات مباشرة، وذلك بالارتباط بالتوكسينات البكتيرية أو بالتشويش على عمل المستقبلات التي تستخدمها الفيروسات والبكتيريا لإصابة الخلايا بالعدوى.

لم يتعرض الأطفال حديثو الولادة للميكروبات من قبل لذلك هم معرضون تعرضاً خاصاً للإصابة بالعدوى. تُوفَّر عدة طبقات من الحماية السلبية من قبل الأم. وفي أثناء الحمل، ينتقل نوع معين من الأجسام المضادة، يسمى الغلوبولين المناعي ج (IgG)، من الأم إلى الطفل مباشرةً عن طريق المشيمة، لذلك يكون لدى الأطفال الرضع مستويات عالية من الأجسام المضادة حتى عند الولادة، لها نفس النطاق من التخصص ضد المستضدات الموجود لدى الأمهات. يحتوي حليب الأم أو اللبأ أيضًا على أجسام مضادة تنتقل إلى أمعاء الطفل وتحميه من العدوى البكتيرية إلى أن يتمكن المولود من تصنيع الأجسام المضادة الخاصة به. هذه مناعة سلبية لأن الجنين لا يصنع في الواقع أي خلايا ذاكرة أو أجسام مضادة، بل يستعيرها فقط. هذه المناعة السلبية عادةً ما تكون قصيرة الأجل، تستمر من بضعة أيام حتى عدة أشهر. في الطب، يمكن أيضًا نقل المناعة السلبية الواقية اصطناعيًا من فرد إلى آخر.
الذاكرة المناعية
عندما تُنشّط الخلايا البائية والخلايا التائية وتبدأ في التضاعف، يُصبح بعض نسلها خلايا ذاكرة طويلة العمر. طوال حياة الحيوان، يمكن لخلايا الذاكرة تذكر كل ممرض محدد واجهته ويمكنها أن تُحدث استجابة قوية إذا دخل هذا الممرض مرة أخرى للجسم. تسمى هذه العملية «بالتكيُّفيّة» أو «المناعة التكيفية» لأنها تنشأ خلال حياة الفرد كتكيف مع العدوى بهذا الممرض وتهيء الجهاز المناعي لمواجهة التحديات المستقبلية. يمكن أن تكون الذاكرة المناعية في شكل ذاكرة سلبية قصيرة المدى أو ذاكرة نشطة طويلة المدى.
التنظيم الفسيولوجي
لجهاز المناعة دور في نواحٍ عديدة تخص التنظيم الفسيولوجي في الجسم، ويتآثر تآثرًا وثيقًا مع أجهزة أخرى مثل جهاز الغدد الصماءوالجهاز العصبي. ويلعب دورا حاسما في تطور الجنين وفي إصلاح الأنسجة وإعادة تجديدها.
الهرمونات
تعمل الهرمونات كمعدِّلات مناعية، وتغير حساسية جهاز المناعة. على سبيل المثال يُعرف بأن الهرمونات التناسلية الأنثوية هي منشطات مناعية لكل من للاستجابة المناعية الفطرية والاستجابة المناعية التكيفية. تصيب بعض أمراض المناعة الذاتية مثل الذئبة الحمامية النساء تحديدًا، وفي الغالب يصادف بدء الإصابة بها سن البلوغ. وفي المقابل تبدو الهرمونات التناسلية الذكرية مثل التستوستيرون بأنها مثبطات للمناعة. تنظم هرمونات أخرى النظام المناعي كذلك، ومن أبرزها: البرولاكتين وهرمون النمو وفيتامين د.
فيتامين د
رغم أن الدراسات الخلوية تشير إلى أن فيتامين د يملك مستقبلات وأن له وظائف محتملة في جهاز المناعة، إلا أنه لا يوجد دليل سريري يثبت أن نقص فيتامين د يزيد من خطر الإصابة بأمراض المناعة أو أن مكملات فيتامين د تقلل من مخاطر الإصابة بأمراض المناعة. ذكر تقرير صادر عن معهد الولايات المتحدة للطب عام 2011 أن "النتائج المتعلقة بـ ... عمل المناعة واضطرابات المناعة الذاتية والالتهابات ... لا يمكن ربطها بنحو موثوق مع مقدار تناول الكالسيوم أو فيتامين د وأن هذه النتائج كانت غالبا متضاربة.
النوم والراحة
يتأثر جهاز المناعة بالنوم والراحة والحرمان من النوم يضر بوظيفته. يبدو أن حلقات تغذية راجعة معقدة تشمل سيتوكيناتٍ مثل: الإنترلوكين 1 وعامل نخر الورم ألفا التي تُنتَج بسبب الإصابة بالممراضات تلعب دورا في تنظيم نوم حركة العين غير السريعة. وبالتالي يمكن أن تتسبب الاستجابة المناعية ضد الإصابة في تغييرات في دورة النوم، بما في ذلك زيادة في نوم الموجة البطيئة مقارنة بنوم حركة العين السريعة.
يمكن أن يكون للتمنيع الفاعل لدى الأفراد الذين يعانون من الحرمان من النوم تأثيرٌ منخفض وقد يودي إلى انخفاض إنتاج الأجسام المضادة وإلى استجابة مناعية منخفضة مقارنة بالأفراد الذين يأخذون قسطا جيدا من النوم والراحة. فضلا عن ذلك، يمكن لبروتينات مثل NFIL3 التي اتضح أن لها علاقة وثيقة بتمايز الخلايا التائية والنظم يوماوي أن يتأثر عملها بسبب اضطرابات دورات الضوء والظلام الناتجة عن حالاتٍ من الحرمان من النوم. يمكن أن تؤدي هذه الاضطرابات إلى زيادة في الأمراض المزمنة مثل: مرض القلب والألم المزمن والربو.
فضلا عن النتائج السلبية للحرمان من النوم، ثبت أن النوم والنظم اليوماوي -المرتبطان ببعضهما- لهما تأثيرات تنظيمية قوية على الوظائف المناعية التي تؤثر على كلا المناعتين الفطرية والتكيفية. فخلال المرحلة المبكرة من نوم الموجة البطيئة، يسبب انخفاضٌ مفاجئ لمستويات الكورتيزول والأدرينالين والنورإبينفرين في الدم ارتفاع مستويات هرمونات اللبتين وهرمون النمو 1 والبرولاكتين فيه، وتسبب هذه الهرمونات حالة محفزة للالتهاب عبر إنتاج سيتوكينات محفزة للالتهاب: الإنترلوكين 1، الإنترلوكين 12، عامل نخر الورم ألفا والإنترفيرون غاما. بعد ذلك تحفز هذه السيتوكينات وظائف المناعة مثل تنشيط الخلايا المناعية وتكاثرها وتمايزها. في أثناء هذا الوقت من التطور البطيء للاستجابة المناعية التكيفية، توجد ذروة في الخلايا غير المتمايزة أو غير مكتملة التمايز مثل الخلايا التائية غير البالغة أو الخلايا التائية الذاكرة المركزية. علاوة على هذه التأثيرات، تدعم بيئة الهرمونات المنتجَة في هذا الوقت (لبتين، هرمون النمو 1، برولاكتين) التآثرات بين الخلايا العارضة للمستضد والخلايا التائية، كما يحدث ميلان في ميزان السيتوكينات المحفزة لتمايز الخلايا التائية المساعدة 1 أو 2 نحو السيتوكينات التي تدعم الخلايا التائية المساعدة 1، كما تحدث زيادة عامة في تكاثر الخلايا التائية المساعدة وهجرة الخلايا التائية غير البالغة إلى العقد اللمفاوية. ويُعتقد أن كل هذا يدعم تكوين ذاكرة مناعية طويلة الأمد عبر بدء استجابات مناعية بواسطة الخلايا التائية المساعدة.
تبلغ الخلايا المستفعَلة المتمايزة مثل: الخلايا القاتلة الطبيعية أو الخلايا التائية القاتلة ذروتها في أثناء فترات اليقظة لتستجيب استجابةً فعالة ضد أي من الممراضات الدخيلة. تبلغ الجزيئات المضادة للالتهاب مثل الكورتيزول والكاتيكولامين ذروتها كذلك خلال فترات اليقظة والنشاط. كان الالتهاب ليسبب اعتلالات جسمية وإدراكية جدية لو حدث في أثناء فترات اليقظة، ويمكن أن يحدث الالتهاب في أثناء فترات النوم بسبب تواجد الميلاتونين. تسبب الالتهابات قدرا كبيرا من الإجهاد التأكسدي وتواجد الميلاتونين في أثناء النوم يمكن أن يناهض بنشاط إنتاج الجذور الحرة في أثناء ذلك الوقت.
التمرين البدني
للتمرينات البدنية تأثير إيجابي على جهاز المناعة، وحسب تواترها وشدتها يمكن أن تخفف من التأثيرات الإمراضية التي تسببها البكتيريا والفيروسات. مباشرة بعد تمرين بدني شديد يحدث تخميد مناعي مؤقت تنقص فيه الخلايا اللمفاوية المتجولة وتنقص كمية إنتاج الأجسام المضادة. يمكن أن يمنح هذا الأمر فرصة سانحة للفيروسات الكامنة لكي تعيد نشاطها وتسبب أمراضا، لكن الأدلة غير حاسمة بهذا الشأن.
تغيرات على المستوى الخلوي
تحدث في أثناء التمرين زيادة في عدد جميع أنواع الكريات البيضاء المتجولة، ويحدث هذا بسبب قوة احتكاك الدم المتدفق مع سطح خلايا البطانة وكذلك الكاتيكولامينات المؤثرة على المستقبلات الأدرينالينية-β. يرتفع عدد الخلايا المتعادلة في الدم ويبقى مرتفعا لمدة ست ساعات مع وجود خلايا غير ناضجة منها. رغم أن زيادة الخلايا المتعادلة (كثرة العدلات) مماثلة للزيادة التي تحدث في أثناء الإصابة بالكتيريا، إلا أن أعدادها ترجع للمستويات الطبيعية بعد زهاء 24 ساعة.
ينخفض عدد الخلايا اللمفاوية المتجولة (بالتحديد الخلايا القاتلة الطبيعية) في أثناء التمرين الشديد لكنه يعود لمستواه بعد 4-6 ساعات. مع أن قرابة 2% من الخلايا تموت، إلا أن معظمها ينتقل إلى الأنسجة وخصوصاً الأمعاء والرئتين وهي الأمكنة التي يزيد فيها احتمال تواجد الممراضات.
تغادر بعض الخلايا الوحيدة الدورة الدموية وتنتقل إلى العضلات أين تتمايز وتصبح بلعميات كبيرة. تتمايز هذه الخلايا إلى نوعين: البلعميات الكبيرة المتكاثرة وهي المسؤولة على زيادة عدد الخلايا العضلية، والبلعميات الكبيرة المرمِّمة والتي لها دور في نضوج الخلايا العضلية المتكونة.
الترميم والتجديد
يلعب جهاز المناعة -المناعة الفطرية تحديدا- دورا حاسما في ترميم الأنسجة بعد تأذيها، ومن العناصر الأساسية في ذلك: البلعميات الكبيرة والخلايا المتعادلة، كما أن الخلايا التائية غاما دلتا والخلايا اللمفاوية الفطرية والخلايا التائية المنظمة لها أدوار مهمة كذلك. مطاوعة الخلايا المناعية والتوازن بين الإشارات المحرضة للالتهاب والإشارات المضادة له جوانب حاسمة في فعالية ترميم الأنسجة. لمكونات جهاز المناعة ومساراته دور في التجديد كذلك، على سبيل المثال تجديد الأطراف لدى عفريت الماء. تبعا لإحدى الفرضيات: يمكن أن تكون الكائنات التي يمكنها التجديد (مثل عفريت الماء) أقل في الكفاءة المناعية من الكائنات التي لا يمكنها التجديد.
الفروق بين الجنسين
الرجال والنساء لديهم نفس الجهاز المناعيّ. ومع ذلك، فإن طبيعة وقوة الاستجابات المناعية في الجنسين مُختلفة. وهذا يؤدي إلى انتشار الأمراض الخبيثة ومظهرها وعلاجها حسب نوع الجنس، كذلك أمراض المناعة الذاتية والأمراض المُعدية.
الالتهابات
وُجد أن الجهاز المناعي يعتمد جزئيًا على هرمون الإستروجين، لذلك قد تكون النساء أكثر حماية ضد بعض الأمراض الفيروسية، مثل أمراض فيروس الأنفلونزا A (على الرغم من أن العوامل الأخرى تلعب دورًا أيضًا ). تنتج خلايا الجهاز المناعي الفطري الخاصة بالنساء أعدادًا أكبر من الإنترفيرون ألفا أثناء التعرض لفيروس نقص المناعة البشرية مقارنةً بخلايا الرجال. مرة أخرى، يُطرح سؤال ما إذا كان هذا من تأثيرات هرمون الاستروجين. أمراض التهاب الكبد B (مثل سرطان الخلايا الكبدية) تنتشر انتشاراً أكثر وضوحا في الجنس الذكري، وفيه يعد التأثير المباشر للهرمونات الجنسية مسؤولاً على تكاثر الفيروس.
ليس فقط شدة الأمراض الفيروسية، ولكن أيضًا حدوث الأمراض الطفيلية وعلاجها (داء الأميبات، وداء الليشمانيات، والتهابات الديدان الطفيلية) يكون الجنس الذكري أكثر حساسية لها، ويُعزى ذلك إلى تأثير الأندروجينات المباشر على جهاز المناعة التي مستواها في البلازما أعلى لدى الرجال. يعد السل أحد أكثر أنواع العدوى البكتيرية شيوعًا بين البشر، فهو يصيب عددًا كبيرًا من الرجال والذي تكون نسبة نجاح علاجه قليلة أيضًا. ويجري التحقيق في أسباب ذلك. في السنوات الأخيرة، اجتذب التعديل المعتمد على الجنس للاستجابة المناعية الناتج عن التطعيم أيضًا اهتمام علماء المناعة
أمراض المناعة الذاتية
بالإضافة إلى الكيمياء الحيوية هناك أيضًا اختلافات جينية في أجهزة المناعة. بعض الجينات التي لها دور في المناعة توجد على الكروموسوم X (عددها مضاعف لدى النساء). عندما لا يحدث تعطيل الكروموسوم X فإن هذه الجينات -مثل TLR 7 (المستقبل الشبيه بتول 7)- يزيد التعبير عنها لدرجة كبيرة، تجعل جهاز المناعة مفرط النشاط لدى النساء، ممّا قد يؤدي إلى أمراض المناعة الذاتية مثل الذئبة الحمامية الشاملة. النساء أيضًا أكثر عرضة للإصابة بأمراض المناعة الذاتية الأخرى، مثل التهاب الأقنية الصفراوية الأولي والتهاب الكبد المناعي الذاتي. الأمر نفسه ينطبق على الأمراض الالتهابية في الجهاز العصبي المركزي مثل التصلب المتعدد وأمراض التهاب النخاع والعصب البصري والتهاب الدماغ المناعي الذاتي بوساطة الأجسام المضادة الذاتية العصبية.
اضطرابات المناعة البشرية
يمكن أن يفشل جهاز المناعة في الدفاع عن المضيف وقد تحدث فيه اضطرابات تنقسم إلى ثلاث فئات رئيسية: نقص المناعة، المناعة الذاتية، وفرط الحساسية.
نقص المناعة
يحدث نقص المناعة حين يكون مكون أو أكثر من مكونات جهاز المناعة غير نشط. تتقلص قدرة جهاز المناعة في الاستجابة للممراضات لدى كل من الصغار وكبار السن، وتبدأ الاستجابات المناعية في الانخفاض عند بلوغ الخمسينات من العمر وذلك بسبب التشيخ المناعي. في الدول المتقدمة تُعتبر السمنة ومعاقرة الكحول وتناول المخدرات من الأسباب الشائعة لضعف وظيفة المناعة، في حين أن سوء التغذية هو أكثر الأسباب شيوعا لنقص المناعة في البلدان النامية. للأنظمة الغذائية التي لا تحتوي على كميات كافية من البروتين صلة بالاعتلالات التي تصيب: المناعة الخلوية، نشاط الجهاز المتمم، وظيفة الخلايا البلعمية، تراكيزالجسم المضاد الغلوبولين المناعي أ، وإنتاج السيتوكينات. يؤدي فقدان الغدة الزعترية في مرحلة مبكرة من العمر بسبب طفرة جينية أو إزالتها جراحيا إلى نقص مناعة حاد وقابلية عالية للإصابة بالأمراض. يمكن لنقص المناعة أن يكون وراثيا أو مكتسبا.عوز المناعة المشترك الشديد هو اضطراب جيني نادر يتميز باعتلال نمو وتطور الخلايا التائية والبائية الوظيفية بسبب حدوث عدة طفرات جينية.داء الورم الحبيبي المزمن الذي تنخفض فية قدرة البلعميات على تدمير الممراضات هو مثال على نقص المناعة الوراثي أو الخلقي. يسبب الإيدز وبعض أنواع السرطان عوز المناعة المكتسب.
المناعة الذاتية

الاستجابات المناعية المفرطة وخاصة أمراض المناعة الذاتية نوع آخر من اختلال وظيفة المناعة، وفيها يفشل جهاز المناعة في التمييز تمييزًا سليمًا بين أنسجة ومكونات الكائن الذاتية وغير الذاتية ويهاجم جزءًا من الجسم. تحت الظروف الطبيعية، تتآثر العديد من الخلايا التائية والأجسام المضادة مع الببتيدات الذاتية. إحدى وظائف الخلايا المتخصصة (المتواجدة في الغدة الزعترية ونخاع العظم) هي عرض المستضدات الذاتية التي تُنتَج في أنجاء الجسم للخلايا اللمفاوية الناشئة والقضاء على الخلايا التي تتعرف على المستضدات الذاتية، الأمر الذي يمنع حدوث المناعة الذاتية. من أمراض المناعة الذاتية الشائعة: التهاب الغدة الدرقية لهاشيموتو،التهاب المفاصل الروماتويدي،سكري النوع الأول،والذئبة الحمامية الشاملة.
فرط التحسس
فرط التحسس هو استجابة مناعية تسبب الضرر لأنسجة الجسم الذاتية، ويُقسَّم إلى أربعة أقسام تبعا للآلية المستخدمة والمدة الزمنية لردة الفعل فرط التحسسية. فرط التحسس من النمط الأول هو ردة فعل مباشرة أو صدمة حساسية ترتبط غالبا مع الحساسية، ويمكن أن تترواح أعراضه من الشعور بالضيق إلى الوفاة، ويحدث بواسطة الغلوبيولين المناعي هـ (IgE) الذي يثير زوال تحبب الخلايا الصارية عندما تُربط تصالبيا مع المستضد. يحدث فرط التحسس عندما ترتبط الأجسام المضادة بالمستضدات الموجودة على خلايا الذاتية للفرد وتسمها من أجل التدمير، ويسمى هذا النوع كذلك بفرط التحسس المعتمد على الجسم المضاد، ويحدث بواسطة الأجسام المضادة: الغلوبيولين المناعي ج (IgG) والغلوبيولين المناعي م (IgM). تثير المعقدات المناعية (تراكمات المستضدات، بروتينات الجهاز المتمم، الأجسام المضادة IgG وIgM) المودَعة في مختلف الأنسجة ردات فعل النوع الثالث من فرط الحساسية. يستغرق النوع الرابع من فرط التحسس (الذي يعرف كذلك بفرط التحسس المؤجل أو المتواسط بالخلية) قرابة يومين إلى ثلاثة أيام ليتطور، ولردات الفعل اتجاهه دورٌ في المناعة الذاتية والأمراض المعدية، ويمكن أن يكون لها دور في التهاب الجلد التماسي. تحدث ردات الفعل هذه بواسطة الخلايا التائية، الخلايا الوحيدة والخلايا البلعمية الكبيرة.
الالتهاب مجهول السبب
الالتهاب هو إحدى الاستجابات الأولى للجهاز المناعي عند الإصابة بالعدوى، لكن يمكن أن يحدث من دون سبب واضح. يحدث الالتهاب بواسطة الإيكوزانويدات والسيتوكينات التي تفرزها الخلايا المصابة أو المجروحة. تشمل الإيكوزانويدات: البروستاغلاندينات التي تسبب الحمى وتوسع الأوعية الدموية المرتبطين بالالتهاب، واللوكوترايينات التي تهاجم بعض الخلايا البيضاء. من السيتوكينات الشائعة التي تسبب الالتهاب: الإنترلوكينات المسؤولة على الاتصالات بين خلايا الدم البيضاء، الكيموكينات التي تحفز الانجذاب الكيميائي، والإنترفيرونات التي لها تأثيرات مضادة للفيروسات مثل إيقاف تخليق البروتين في الخلية المضيفة. يمكن أن إفراز عوامل النمو والعوامل السامة للخلايا كذلك. تجنِّد هذه الستوكينات الخلايا المناعية إلى موقع الإصابة وتحفز شفاء أي نسيج تضرر نتيجة القضاء على الممراضات.
التلاعب بالمناعة في الطب
يمكن التلاعب بآليات عمل جهاز المناعة لتثبيط الاستجابات المناعية غير المرغوب فيها والتي تنتج عنها مناعة ذاتية أو حساسية أو رفضٌ للأعضاء المزروعة، وتحفيز الاستجابات التي تحمي ضد الممراضات التي تتجنب جهاز المناعة بفعالية وضد السرطان.
تثبيط المناعة
تُستخدم الأدوية المثبطة للمناعة للتحكم في اضطرابات المناعة الذاتية أو الالتهابات حين يحدث ضرر كبير للأنسجة الذاتية، ولمنع رفض الأعضاء بعد زراعتها.
غالبا ما تُستعمل الأدوية المضادة للالتهاب للتحكم في تأثيراته. تعتبر الهرمونات القشرية السكرية أقوى هذه الأدوية تأثيرا ويمكن أن تسبب عدة تأثيرات جانبية غير مرغوب فيها مثل: السمنة البطنية، فرط سكر الدم وهشاشة العظام. واستخدامها يخضع لرقابة محكمة. غالبا ما تُستخدم جرعات منخفضة من الأدوية المضادة للالتهاب بالتزامن مع أدوية سامة للخلايا أو مثبطة للمناعة مثل ميثوتركسيت وآزاثيوبرين.
تثبط الأدوية السامة للخلايا جهاز المناعة عبر قتل الخلايا المنقسمة مثل الخلايا التائية المنشطة. يسبب هذا القتل العشوائي تأثر الخلايا الأخرى دائمة الانقسام وأعضاؤها كذلك بتأثيرات جانبية سامة. تمنع الأدوية المثبطة للمناعة مثل سيكلوسبورين الخلايا التائية من الاستجابة للإشارات استحابةً صحيحةً عبر تثبيط مسارات نقل الإشارة.
تنشييط المناعة
تفتقر الادعاءات التي يصرح بها المسوِّقون لمختلف المنتجات ومقدمو العلاجات البديلة مثل: المعالجة اليدوية والمعالجة المثلية والوخز بالإبر بأنها قادرة على تحفيز أو تعزيز ودعم جهاز المناعة إلى شرح مفيد ودليل على الفعالية.
التلقيح

تُكتسب المناعة النشطة طويلة الأمد عقب الإصابة بالعدوى عبر تنشيط الخلايا التائية والبائية. يمكن توليد المناعة النشطة بطريقة غير طبيعية كذلك عبر التلقيح. مبدأ التلقيح (ويسمى أيضا التطعيم أو التمنيع) هو إدخال مستضدٍ من ممراض ما في الجسم لتحفيز جهاز المناعة لتطوير مناعة مخصصة ضد ذلك الممراض من دون التسبب في المرض الذي يحدثه. ينجح التحفيز المتعمد لاستجابة مناعية لأنه يستغل التخصصية الطبيعية لجهاز المناعة وكذلك قابليته للتحفيز. مع بقاء الأمراض المعدية أحد الأسباب الرئيسية للوفاة لدى البشر، تمثل اللقاحات الحل الأكثر فعالية للتلاعب بجهاز المناعة الذي توصل الإنسان إليه.
العديد من اللقاحات مبنية على المكونات اللاخلوية للكائنات الدقيقة، بما في ذلك الذيفانات غير المؤذية. بما أن العديد من المستضدات المشتقة من لقاحات لاخلوية لا تثير استجابة مناعية تكيفية قوية، توفر معظم اللقاحات ضد البكتيريا مساعِدات إضافية تنشط الخلايا المقدمة للمستضد الخاصة بجهاز المناعة الفطري وتزيد توليد المناعة للحد الأقصى.
علم المناعة الورمي
أحد أدوار جهاز المناعة المهمة الأخرى هو التعرف على الأورام والقضاء عليها، ويسمى ذلك بالمراقبة المناعية. تعبِّر الخلايا الورمية المتحولة عن مستضدات لا تتواجد لدى الخلايا العادية، ويعتبر جهاز المناعة هذه المستضدات بأنها دخيلة، وتواجدها يجعل الخلايا المناعية تهاجم الخلايا الورمية المتحولة. للمستضدات التي تعبر عنها الأورام مصادر عدة، فبعضها مشتق من فيروسات مسرطنة مثل فيروس الورم الحليمي البشري الذي يسبب سرطانات: عنق الرحم،الفرج، المهبل، القضيب، الفم والحلق. بينما مستضدات أخرى هي بروتينات الكائن الذاتية التي تظهر بمستويات منخفظة في الخلايا العادية لكنها تبلغ مستويات عالية في الخلايا الورمية. أحد الأمثلة عليها هو إنزيم يسمى تايروسيناز والذي يحوِّل بعض خلايا الجلد (مثل الخلايا الميلانينية) إلى أورام تسمى الأورام الميلانينية إذا عُبّر عنه بمستويات عالية. مصدر ثالث محتمل لمستضدات الأورام هو البروتينات التي تكون في الحالة العادية مهمة لتنظيم نمو الخلايا وبقائها، لكنها تتطفر تطفراً شائعًا إلى بروتينات مسببة للسرطان ومن الأمثلة عليها الجزيئات الناتجة عن الجينات الورمية.
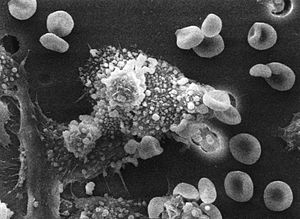
الاستجابة الرئيسية لجهاز المناعة ضد الأورام هي تدمير الخلايا غير الطبيعية باستخدام الخلايا التائية القاتلة، بدعم من الخلايا التائية المساعدة في بعض الأحيان. تُعرض مستضدات الورم على جزيئات معقد التوافق النسيجي الكبير القسم 1 بطريقة مماثلة للمستضدات الفيروسية. يسمح هذا العرض للخلايا التائية القاتلة بالتعرف على خلايا الورم بأنها غير طبيعية. تقتل الخلايا القاتلة الطبيعية الخلايا الورمية بطريقة مماثلة، خاصة إذا كانت الخلايا الورمية تحتوي في أسطحها على جزيئات أقل من العادة من معقد التوافق النسيجي الكبير القسم 1، وهي ظاهرة شائعة في الأورام. في بعض من الأحيان تُولَّد أجسام مضادة للخلايا الورمية وهو ما يسمح للجهاز المناعي المتمم بتدميرها.
تتجنب بعض الأورام جهاز المناعة وتتطور لتصبح سرطانات. تملك الخلايا الورمية في الغالب أعدادا منخفضة من جزيئات معقد التوافق النسيجي الكبير القسم 1 على سطحها، وبالتالي تتجنب رصدها بواسطة الخلايا التائية القاتلة. تفرز بعض الخلايا الورمية جزيئات تثبط الاستجابة المناعية، على سبيل المثال إفراز السيتوكين عامل النمو المحول بيتا (TGF-β) الذي يمنع نشاط البلعميات الكبيرة والخلايا اللمفاوية. فضلا عن ذلك، يمكن أن يتطور تحمل مناعي ضد مستضدات الأورام فيتوقف جهاز المناعة عن مهاجمة الخلايا الورمية.
من المفارقات أن البلعميات الكبيرة يمكن أن تحفز نمو الورم حين ترسل الخلايا الورمية سيتوكينات تجذب البلعميات الكبيرة التي تُفرِز بدورها سيتوكينات وعوامل نمو مثل عامل نخر الورم ألفا الذي يرعى ويعمل على تطور الورم أو يحفز مطاوعةً مماثلة لنظيرتها لدى الخلايا الجذعية. تجعل توليفةٌ من نقص التأكسج في الورم والسيتوكينات المنتجة بواسطة البلعميات الكبيرة الخلايا الورميةَ تخفض من إنتاج بروتين يمنع الانبثاث وبالتالي تساهم في انتشار الخلايا السرطانية. تُجنَّد البلعميات الكبيرة M1 المضادة للورم في المراحل الأولى من تطور الورم لكنها تتمايز مع الوقت إلى النوع M2 الذي له تأثير مؤيد للورم وهي مثبطة للمناعة. يخفض نقص التأكسج من إنتاج السيتوكينات التي تعمل على إحداث استجابة مضادة للورم، وتكتسب البالعات الكبيرة تدريجيا وظائف النوع M2 المؤيدة لنمو الورم التي تُحدثها البيئة المكروية للورم، بما في ذلك: الإنترلوكين 4 والإنترلوكين 10. تشمل المعالجة المناعية للسرطان السبل الطبية لتحفيز جهاز المناعة لمهاجمة الأورام السرطانية.
التنبؤ بتوليد المناعة
يمكن أن تسبب بعض من الأدوية استجابة مناعية محيِّدة، ويُنتج عندها جهاز المناعة أجسام مضادة محيِّدة تناهض تأثير الأدوية، وخاصة الأدوية المتناولة تناولًا متواترًا أو بجرعات كبيرة. يحدّ هذا الأمر من فعالية الأدوية المبنية على ببتيدات كبيرة وبروتينات (التي يزيد حجمها عادة على 6000 دالتون). في بعض الحالات، يكون الدواء في حد ذاته غير مولد للمناعة لكن يُؤخذ جنبًا إلى جنب مع مكونات مولدة للمناعة كما هو الحال بالنسبة لتاكسول. طُورت أساليب حاسوبية للتنبؤ باستمناعية (القدرة على توليد المناعة) الببتيدات والبروتينات، وهي مفيدة إفادة خاص في: تصميم الأجسام المضادة العلاجية، تقييم احتمالية الطفرات في زيادة حدة إمراض الفيروسات والتحقق من فعالية علاجات الأدوية المُقترَحة المبنية على الببتيد. اعتمدت التقنيات القديمة أساسا على ملاحظة أن الأحماض الأمينية المحبة للماء تتواجد تواجداً أكبر بكثير في مناطق الحواتم من الأحماض الأمينية الكارهة للماء، لكن التطورات الحديثة تعتمد على تعلم الآلة للتقنيات باستخدام قواعد بيانات الحواتم المعروفة مسبقا التي تخص البروتينات الفيروسية المدروسة جيدا كمجموعة تتدرب عليها الآلة. أُنشِئت قاعدة بيانات متاحة للعموم لفهرسة الحواتم التي تخص الممراضات المعروفِ بأن الخلايا البائية قادرة على التعرف عليها. يسمى المجال الجديد الذي يدرس المعلوماتية الحيوية المرتبطة بتوليد المناعة بعلم المناعة الحاسوبي.البروتيوميات المناعية هي دراسة مجموعات كبيرة من البروتينات (بروتيوميات) التي لها دور في الاستجابة المناعية.
التطور وآليات أخرى
تطور جهاز المناعة
من المحتمل أن يكون جهاز المناعة التكيفي متعدد المكونات قد نشأ لدى الفقاريات أولا، لأن اللافقاريات لا تخلِّق خلايا لمفاوية ولا تولِّد استجابة مناعية خلطية مبنية على الأجسام المضادة. تستخدم العديد من الكائنات والأنواع آليات يبدو أنها سلفٌ للآليات التي تستخدمها مناعة الفقاريات. يوجد جهاز المناعة لدى جميع أشكال الحياة وحتى البسيطة منها، وتستخدم البكتيريا آلية دفاع فريدة تسمى نظام تعديل التقييد لتحمي نفسها من ممراضات فيروسية تسمى العاثيات. تملك بدائيات النوى (البكتيريا والعتائق) مناعة تكيفية كذلك، من خلال نظام يستخدم تسلسلات كريسبر لإبقاء قطع من جينومات العاثيات التي أصابتها في الماضي في جينومها، ويتيح لها ذلك منع تضاعف الفيروس عبر نوعٍ من تدخل الرنا. تملك بدائيات النوى آليات دفاع أخرى كذلك، وتتواجد العناصر المهاجمة من جهاز المناعة لدى حقيقيات النوى وحيدة الخلية لكن الدراسات حول أدوارها في الدفاع قليلة.
مستقبل التعرف على الأنماط هي بروتينات تُستخدم بواسطة جميع الكائنات تقريبا للتعرف على الجزيئات ذات الصلة بالممراضات. الببتيدات المضادة للميكروبات التي تسمى الديفنسينات هي مكون تطوري محفوظ لجهاز المناعة الفطري وتوجد لدى جميع الحيوانات والنباتات، وتمثل الهيئة الرئيسية لجهاز المناعة لدى اللافقاريات.الجهاز المتمم والخلايا البلعمية هي أكثر أنواع المناعة المستخدمة بواسطة هيئات الحياة اللافقارية. الريبونوكليازات ومسار تدخل الرنا محفوظان لدى جميع حقيقيات النوى، ويُعتقد أنهما يلعبان دورا في الاستجابة المناعية ضد الفيروسات.
لا تملك النباتات خلايا بلعمية -على خلاف الحيوانات- لكن العديد من الاستجابات المناعية للنباتات تتضمن إشارات كيميائية نظامية تُرسل عبر مختلف أنحاء جسم النبات. تستجيب الخلايا النباتية الفردية للجزيئات ذات الصلة بالفيروسات عبر التعرف على الأنماط الجزيئية المرتبطة بالممراض (PAMPs). حين يصاب جزء من النبات بالعدوى، يُحدِث النبات استجابة فرط تحسسية موضعية، تخضع فيها الخلايا الموجودة في موقع العدوى إلى استماتة سريعة لمنع انتشار المرض إلى أجزاء أخرى من النبات. المقاومة المكتسبة النظامية هي نوع من الاستجابة المناعية المستخدمة بواسطة النباتات لجعل كامل جسم النبتة مقاوم لممراض محدد. آليات إسكات الرنا مهمة خصوصًا في هذه الاستجابة النظامية لأن بإمكانها منع تضاعف الفيروس.
جهاز مناعة تكيفي بديل
حدث تطور جهاز المناعة التكيفي لدى سلفٍ من الفقاريات الفكية. العديد من الجزيئات الخاصة بجهاز المناعة التكيفي مثل (الغلوبولينات المناعية (Ig)، مستقبلات الخلايا التائية (TCR) ومعقد التوافق النسيجي الكبير(MHC)) تتواجد لدى الفقاريات الفكية فقط. مع ذلك، اكتشفت جزئيات مميزة تفرزها الخلايا اللمفاوية لدى الفقاريات اللافكية مثل: الجلكيات والأسماك المخاطية. تمتلك هذه الحيوانات مجموعة كبيرة من الجزيئات تسمى مستقبلات الخلية اللمفاوية المتغيرة (VLRs) والتي -على غرار مستقبلات المستضد الخاصة بالفقاريات الفكية- تُنتج من عدد قليل (واحد أو إثنين) من الجينات. يُعتقد بأن هذه الجزيئات ترتبط بمستضدات الممراض بطريقة مشابهة للأجسام المضادة، وبنفس الدرجة من التخصصية.
التلاعب بواسطة الممراضات
يعتمد نجاح أي ممراض على قدرته في تفادي الاستجابات المناعية للمضيف الذي يصيبه، لذلك طورت الممراضات طرقا عديدة تسمح لها بإصابة المضيف بنجاح مع تجنب اكتشاف أو تدمير جهاز المناعة لها. تتغلب البكتيريا على الحواجز الفيزيائية غالبا عبر إفراز إنزيمات تهضم هذه الحواجز، على سبيل المثال: عبر استخدم نظام الإفراز النوع 2. وفي طريقة أخرى تستخدم نظام الإفراز النوع 3، وفيها تُدخل أنبوبا أجوفا داخل الخلية المضيفة يتيح طريقا مباشرا للبروتينات كي تنتقل من الممراض إلى المضيف. تُستخدم هذه البروتينات في الغالب لإيقاف دفاعات المضيف.
إحدى استراتيجيات التجنب المستخدمة بواسطة العديد من الممراضات لتفادي جهاز المناعة الفطري هي الاختباء ضمن الخلايا الخاصة بالمضيف (ويسمى كذلك الإمراض بين الخلوي)، وفيه يقضي الممراض معظم دورة حياته داخل خلايا المضيف، أين يكون محميا من التآثر المباشر مع الخلايا المناعية والأجسام المضادة والجهاز المتمم. من الأمثلة على الممراضات بين الخلوية: الفيروسات، بكتيريا التسمم الغذائي السلمونيلا والطفيليات حقيقية النوى التي تسبب المالاريا (المتصورة) وداء الليشمانيات (ليشمانيا). تعيش بعض البكتيريا الأخرى مثل المتفطرة السلية داخل كبسولات واقية تحميها من التحلل بواسطة الجهاز المتمم. تفرز العديد من الممراضات مركبات تُضعف الاستجابة المناعية للمضيف أو تعمل على تضليلها. تشكل بعض البكتيريا أغشية حيوية رقيقة لحماية أنفسها من خلايا وبروتينات الجهاز المناعي. وتتواجد مثل هذه الأغشية الرقيقة في العديد من الإصابات بالعدوى الناجحة، كما هو الحال عند الإصابة بالزائفة الزنجارية والبيركهولدرية البصلية الجديدة التي هي من سمات التليف الكيسي. تخلِّق بعض البكتيريا بروتينات سطحية ترتبط بالأجسام المضادة وتجعلها غير فعالة، ومن الأمثلة عليها: العقدية (البروتين غ)، المكورة العنقودية الذهبية (البروتين أ) والهضمونية العقدية ماغنوس (البروتين ل).
الآليات المستخدمة لتفادي جهاز المناعة التكيفي أكثر تعقيدا. أبسط الطرق هي التغيير السريع للحاتمات غير الأساسية (أحماض أمينية و/أو سكريات) على سطح الممراض، مع إبقاء الحاتمات الأساسية مستورة. يسمى هذا بالتغير المستضدي. أحد الأمثلة هو فيروس الإيدز الذي يتطفر بسرعة، لكي تتغير باستمرار البروتينات الموجودة على سطح غلافه الفيروسي التي يستخدمها للدخول إلى المضيف. يمكن أن تفسِّر هذه التغيرات المتواترة في المستضدات فشل اللقاحات المطورة ضد هذا الفيروس. يستخدم طفيلي المثقبية البروسية إستراتيجية مماثلة، يغير فيها باستمرار بروتيناته السطحية من نوع لآخر، ويمنحه ذلك السبق ويمكِّنه من تجنب استجابة الأجسام المضادة. إخفاء المستضدات بجزيئات المضيف هي استراتيجية شائعة أخرى لتجنب الانكشاف لجهاز المناعة. في فيروس الإيدز، الغلاف الذي يغطي الفيروس مصنوع من الغشاء الخارجي للخلية المضيفة، وهذا «الستر الذاتي» للفيروسات يصعِّب مهمة الجهاز المناعي في اكتشاف وتحديد الجزيئات والبُنى «غير الذاتية».
تاريخ علم المناعة
علم المناعة هو العلم الذي يدرس بنية ووظيفة الجهاز المناعي، ونشأ من الطب والدراسات المبكرة حول أسباب المناعة ضد الأمراض. أقدم إشارة معروفة للمناعة كانت خلال طاعون أثينا في 430 قبل الميلاد. لاحظ ثوقيديدس أن الأشخاص الذين تعافوا من نوبة سابقة للمرض يمكنهم الاهتمام بالمرضى وخدمتهم دون أن يصابوا بالمرض مرة ثانية. في القرن الثامن عشر، أجرى بيير لوي موبرتوي تجاربا بسم العقرب ولاحظ أن بعض الكلاب والفئران محصنة ضد هذا السم. في القرن العاشر، كتب الطبيب الفارسي أبو بكر الرازي (المعروف أيضًا باسم الرازي) أول نظرية مسجلة عن المناعة المكتسبة مشيرًا إلى أن الأشخاص الذين نجوا من وباء الجدري لديهم حصانة ضد الإصابة بالجدري مستقبلًا. على الرغم من أنه شرح المناعة بأنها طردُ «الرطوبة الزائدة» من الدم -ومنه منع حدوث المرض مرة ثانية- فقد فسرت هذه النظرية العديد من الملاحظات حول الجدري المعروفة خلال هذا الوقت.
استغل لويس باستور هذه الملاحظات وغيرها المتعلقة بالمناعة المكتسبة في تطويره للتطعيم واقترح نظريته القائلة بالأصل الجرثومي للمرض. كانت نظرية باستور في تعارض تام مع النظريات المعاصرة للمرض، مثل نظرية ميازما. ولم يثبت أن الكائنات المجهرية هي سبب الأمراض المعدية إلا بعد أن أثبت ذلك روبرت كوخ في عام 1891 وحصل على جائزة نوبل في عام 1905 م. وتأكدت الفيروسات باعتبارها من مسببات الأمراض البشرية في عام 1901، مع اكتشاف فيروس الحمى الصفراء بواسطة ولتر ريد.
حقق علم المناعة تقدمًا كبيرًا في نهاية القرن التاسع عشر، من خلال التطورات السريعة التي حصلت على دراسة المناعة الخلطية والمناعة الخلوية. وممَّا يكتسي أهمية خاصة العمل الذي قام به بول إرليش، الذي اقترح نظرية السلسلة الجانبية لتوضيح خصوصية تفاعل الجسم المضاد والمستضد؛ وقد اعتُرف بمساهماته في فهم المناعة الخلطية بحصوله على جائزة نوبل في عام 1908 بالاشتراك مع إيليا ميتشنيكوف مؤسس علم المناعة الخلوية. في عام 1974، طور نيلس كاي يرني نظرية الشبكة المناعية وحصل على جائزة نوبل في عام 1984 مع جورج كوهلر وسيزار ميلشتاين عن نظريات تتعلق بجهاز المناعة.
انظر أيضًا
المراجع
بِاللُغة العربيَّة
بِاللُغة الألمانية
بِاللُغة الإنجليزيِّة
قراءة معمقة
المراجع مرتبة حسب تاريخ النشر
- Silverstein AM (1989). A History of Immunology (بالإنجليزية). Academic Press. ISBN 978-0-08-092583-7.
-
Stvrtinová V, Jakubovský J, Hulín I (1995). Pathophysiology: Principles of Disease (بالإنجليزية). Computing Centre, Slovak Academy of Sciences: Academic Electronic Press.
{{استشهاد بكتاب}}: صيانة CS1: أسماء متعددة: قائمة المؤلفين (link) -
Janeway CA, Travers P, Walport M (2001). Immunobiology (بالإنجليزية) (5th ed.). Garland Science. Archived from the original on 2023-03-12.
{{استشهاد بكتاب}}: صيانة CS1: أسماء متعددة: قائمة المؤلفين (link) -
Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walters P (2002). Molecular Biology of the Cell (بالإنجليزية) (Fourth ed.). New York and London: Garland Science. ISBN 978-0-8153-3218-3. Archived from the original on 2023-03-14.
{{استشهاد بكتاب}}: صيانة CS1: أسماء متعددة: قائمة المؤلفين (link) -
Wira CR, Crane-Godreau M, Grant K (2004). Mucosal Immunology (بالإنجليزية). San Francisco: Elsevier. ISBN 0-12-491543-4.
{{استشهاد بكتاب}}: صيانة CS1: أسماء متعددة: قائمة المؤلفين (link) - Bertok L, Chow D (2005). Bertok L, Chow D (ed.). Natural Immunity (بالإنجليزية) (1st ed.). Vol. 5. ISBN 978-0-44451-755-5.
- Janeway CA (2005). Immunobiology (بالإنجليزية) (6th ed.). Garland Science. ISBN 0-443-07310-4.
-
Krishnaswamy G, Ajitawi O, Chi DS (2006). "The human mast cell: an overview". Mast Cells. Methods in Molecular Biology (بالإنجليزية). Vol. 315. pp. 13–34. doi:10.1385/1-59259-967-2:013. ISBN 1-59259-967-2. PMID 16110146.
{{استشهاد بكتاب}}: صيانة CS1: أسماء متعددة: قائمة المؤلفين (link) - Reece J (2011). Campbell biology. Frenchs Forest, N.S.W: Pearson Australia. ISBN 978-1-4425-3176-5. OCLC 712136178.
- Rajalingam R (2012). Immunogenetics. Methods in Molecular Biology (بالإنجليزية). Vol. 882. pp. 391–414. doi:10.1007/978-1-61779-842-9_23. ISBN 978-1-61779-841-2. PMID 22665247.
- Ciccone CD (2015). Pharmacology in Rehabilitation (Contemporary Perspectives in Rehabilitation) (بالإنجليزية) (5th ed.). F.A. Davis Company. ISBN 978-0-80364-029-0.
- Murphy K, Weaver C (2016). Immunobiology (بالإنجليزية) (9 ed.). Garland Science. ISBN 978-0-8153-4505-3.
- Iriti M (2019). Plant Innate Immunity 2.0 (بالإنجليزية). Basel: MDPI. doi:10.3390/books978-3-03897-581-6. ISBN 978-3-03897-580-9. OCLC 1105775088.
- L. Sompayrac (2019). How the immune system works (بالإنجليزية). Hoboken, NJ: Wiley-Blackwell. ISBN 978-1-119-54212-4. OCLC 1083261548.
وصلات خارجية
- كتاب علم الأحياء الدقيقة والمناعة عبر الإنترنت - من جامعة كارولاينا الجنوبية كلية الطب (المستوى الجامعي).
|
أعضاء الجهاز اللمفاوي
| |||||||||
|---|---|---|---|---|---|---|---|---|---|
| أعضاء أولية |
|
||||||||
| أعضاء ثانوية |
|
||||||||
| |||||||||
| الجهاز العضلي الهيكلي |
|
||||||
|---|---|---|---|---|---|---|---|
| الجهاز القلبي الوعائي |
|
||||||
| جهاز عصبي | |||||||
| الجهاز اللحافي | |||||||
| الجهاز المناعي | |||||||
| الجهاز التنفسي | |||||||
| الجهاز الهضمي | |||||||
| الجهاز البولي | |||||||
| الجهاز التناسلي | |||||||
| جهاز الغدد الصماء | |||||||
| المصطلحات الطبية |
|
||||||
| أنظمة مناعية | |
|---|---|
| الأضداد والمستضدات | |
| خلايا مناعية | |
| المناعة مقابل التحمل | |
| وراثيات مناعية | |
| غيرها | |
| الإنزيمات الهضمية | |
|---|---|
| تجلط الدم | |
| جملة المتممة | |
| Other جهاز مناعي | |
| زعاف | |
| Other | |
| التصنيفات الطبية | |
|---|---|
| المعرفات الخارجية |
|






