علم التخلق
علم ما فوق الجينات (بالإنجليزية: Epigenetics) أو علمُ التَّخَلُّق أو علم التخلق المتعاقب أو علم التخلق المتوالي هو دراسة التغيرات التي تحدث لنمط ظاهري وراثي لأسباب لا تتعلق بتغير تسلسل الدنا. والسابقة الإغريقية "epi" (ἐπι «فوق، خارج، حول») تعني في علم ما فوق الجينات ميزات أو آليات تكون «فضلا على» أو «زيادة عن» الأسس الجينية التقليدية للوراثة. لعلم ما فوق الجينات عادة دور في التغيُّرات التي تؤثر على نشاط الجين والتعبير عنه، لكن يمكن استخدام المصطلح كذلك لوصف أي تغيرٍ وراثي في نمط ظاهري. يمكن أن تَنتج هذه التأثيرات في السمات الظاهرية الفيسيولوجية والخلوية من عوامل خارجية أو بيئية، أو تكون جزءا من النمو الطبيعي. التعريف النموذجي لعلم ما فوق الجينات يتطلب أن تكون هذه التغيرات في الأنماط الظاهرية وراثيةً في نسل كلٍ من الخلايا أو الكائنات.
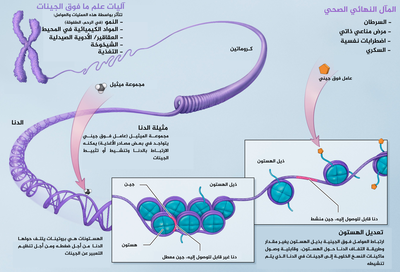
المصطلح يشير كذلك إلى التغيرات في حد ذاتها: التغيُّرات الوظيفية للجينوم التي لا تشمل تغيرات في تسلسل النوكليوتيدات. من الأمثلة على الآليات التي تُحدث مثل هذه التغيرات: مثيلة الدنا وتعديل الهستونات اللذان يغير كل منهما كيفية التعبير عن الجينات من دون تغيير تسلسل الدنا الخاص بها. يمكن التحكم في التعبير الجيني عبر البروتينات المثبطة التي ترتبط بمناطق الكاتم في الدنا. يمكن أن تستمر هذه التغيرات فوق الجينية خلال انقسامات الخلية طوال مدة حياة الخلية، ويمكن أن تستمر حتى لعدة أجيال. ورغم أن هذه التغيرات لا تشمل تغيرات في تسلسل الدنا الخاص بالكائن، إلا أن العوامل فوق الجينية تتسبب في تصرف الجينات (التعبير عن نفسها) على نحو مختلف.
أحد الأمثلة على تغيرٍ فوق جينيٍ في علم أحياء حقيقيات النوى هو عملية التمايز الخلوي. أثناء التخلق التشكلي تصبح الخلايا الجذعية شاملة القدرة مختلف السلالات الخلوية متعددة القدرات التي تكون الجنين، والتي تصبح بدورها خلايا متمايزة كليا. بعبارة أخرى تنقسم بويضة ملقحة واحدة -الزيجوت- وتستمر بالانقسام حتى تنتج جميع أنواع الخلايا الخاصة بالكائن مثل: العصبونات، الخلايا العضلية، النسيج الطلائي والبطانة الغشائية والأوعية الدموية... عبر تنشيط جينات معينة وتثبيط التعبير عن أخرى.
تاريخيا، تم وصف بعض الظواهر التي ليست وراثية بالضرورة على أنها فوق جينية. على سبيل المثال اُستخدم المصطلح «فوق جيني» لوصف أي تعديلٍ لمناطق صبغية، خاصة تعديلات الهستون سواء كانت هذه التعديلات وراثية أم لم تكن وكذلك سواء كانت مرتبطة بنمط ظاهري أو لا. التعريف المجمع عليه حاليا يتطلب أن تكون السمة وراثيةً ليتم اعتبارها بأنها فوق جينية.
تاريخ وتعريفات
ظهر مصطلح علم الجينات الفوقي باستخدامه المعاصر في عقد 1990، لكن ولعدة سنوات كان يُستخدم بمعانٍ مختلفة قليلا. تم الإجماع على صياغة تعريف لمفهوم سمة فوق جينية بأنها «نمط ظاهري وراثي مستقر ينتج عن تغيراتٍ في صبغي من دون تغيرات في تسلسل الدنا» في اجتماع بمختبر كولد سبرينغ هاربر في2008، ورغم ذلك مازالت تُستخدم تعريفات بديلة تشمل السمات غير الوراثية.
مصطلح تخلق فوقي (epigenesis) يعني بشكل عام «نمو إضافي» وهو يستخدم في اللغة الإنجليزية منذ القرن السابع عشر.
استقناء وادينجتون، عقد 1940
من المعنى العام لكلمة تخلق فوقي (epigenesis) - والصفة ذات الصلة «فوق جيني» (epigenetic) - ابتكر عالم الأجنة البريطاني كونراد وادينجتون مصطلح علم مافوق الجينات (epigenetics) سنة 1942 قياسا على مصطلح علم الجينات الظاهري (phenogenetics) الذي صاغه فالنتين هيكر. يشير علم الجينات الفوقي في سياق البيولوجيا في مرحلة النمو الجنيني إلى تمايز الخلايا الجذعية من حالتها الأولية شاملة القدرة.
حين صاغ وادينجتون المصطلح، كانت الطبيعة المادية للجينات ودورها في الوراثة غير معروف. واستخدمها بدل ذلك كنموذج مفاهيمي لكيفية احتمال تآثر المكونات الجينية مع المحيط لإنتاج نمط ظاهري، واستخدم عبارة «مشهد عام فوق جيني» كتعبير مجازي حول النمو البيولوجي. آمن وادينجتون أن مصائر الخلية تُحدد أثناء النمو في عملية سماها الاستقناء تماما مثل تدحرج كجة إلى أسفل نقطة من مرتفع محلي. واقترح وادينجتون مشاهدة تمايز خلوي متزايد غير قابل للعكس مثل ارتفاع التلال بين الوديان التي تسافر الكجج (شبهها بالخلايا) فيها.
في الوقت الحالي، تم ترسيم فكرة وادينجتون المتعلقة «بالمشهد العام فوق الجيني» بصرامة في سياق منهج ديناميكيات النظام لدراسة مصير الخلية. يُتوقع أن تحديد مصير الخلية يُظهر بعض الديناميكيات مثل جاذب-تقارب (يمكن أن يكون الجاذب نقطة توازن، دورة الحد أو جاذب غريب) أو تذبذبي.
التعريف المعاصر
يعرف روبن هوليداي علم الجينات الفوقي على أنه «العلم الذي يدرس آليات التحكم الزماني والمكاني في نشاط الجين أثناء نمو الكائنات المعقدة». وبالتالي، في معنى أكثر شمولا: يمكن أن يُستخدم مصطلح فوق جيني لوصف أي شيء يؤثر على نمو كائنٍ باستثناء تسلسل الدنا. تتّبع الاستخداماتُ الأحدث للمصطلح تعريفاتٍ أكثر صرامة، وقد عرفه أرثر ريغز وزملاؤه على أنه «العلم الذي يدرس تغيرات الانقسام المتساو و/أو الانقسام المنصف الوراثية في وظيفة جين والتي لا يمكن تفسيرها بتغيرات في تسلسل الدنا».
يُستخدم المصطلح كذلك لوصف العمليات التي لم يُثبت أنها وراثية مثل بعض أنواع تعديل الهستون، وبالتالي هناك محاولات لإعادة تعريف «علم الجينات الفوقي» بشكل أوسع يسمح بتجنب القيود التي تتطلب الوروثية. على سبيل المثال يُعرف أدريان بيرد علم الجينات الفوقي بأنه «تكيف بنيوي لمناطق صبغية لكي تسجل أو تشير أو تخلِّد حالات نشاط معدَّلة». هذا التعريف سيكون شاملا للتعديلات المؤقتة المتعلقة بترميم الدنا أو أطوار دورة الخلية وكذلك التغييرات المستقرة المحافظ عليها خلال عدة أجيال خلوية، لكنه سيستبعد عمليات أخرى مثل قولبة معمارية الغشاء والبريونات إلا إذا كان لها تأثير على وظيفة الصبغي. إعادت تعريف كهذه ليست مقبولة بالإجماع ومازالت محل نقاشات. يستخدم «مشروع خريطة طريق علم الجينات الفوقي» الخاص بمعاهد الصحة الوطنية الأمريكية والجاري منذ 2016 التعريف التالي: «لأهداف هذا المشروع، يشير علم الجينات الفوقي إلى كِلا التغيرات الوراثية في نشاط الجين والتعبير عنه (في نسل الخلايا أو الأفراد)، وكذلك التغيرات المستقرة طويلة الأمد في قدرة النسخ في الخلية والتي ليست وراثية بالضرورة.» في 2008، تم الإجماع على تعريف سمة فوق جينية على أنها «نمط جيني مستقر وراثي ناتج عن تغيرات في الصبغي من دون تغيرات في تسلسل الدنا»، في اجتماع بمختبر كولد سبرينغ هاربر.
ولَّد تشابه المصطلح علم الجينات الفوقي بمصطلح علم الجينات العديد من الاستخدامات الموازية. مصطلح «جينوم فوقي» استخدام موازي لمصطلح جينوم ويشير إلى الحالة الإجمالية فوق الجينية للخلية. وعلم الجينوم الفوقي يشير إلى مجمل دراسات التغيرات فوق الجينية عبر كامل الجينوم. مصطلح «شيفرة جينية» تم تكييفه كذلك إلى «شيفرة فوق جينية» والتي تستخدم لوصف مجموعة من الميزات فوق الجينية التي تُنشِئ أنماطا ظاهرية مختلفة في خلايا مختلفة تحتوي على نفس تسلسل الدنا. يمكن أن يعبر مصطلح «الشيفرة فوق الجينية» على الحالة الإجمالية للخلية، مع الأخذ في الحسبان موضع كل جزيء في خريطة فوق جينية، تمثيل تخطيطي للتعبير عن الجين، حالة مثيلة الدنا وتعديل الهستون في منطقة جينومية محددة. يُستخدم المصطلح نموذجيا للإشارة إلى مجهودات نظامية لقياس نماذج معلومات فوق جينية محددة ذات صلة مثل شيفرة الهستون وأنماط مثيلة الدنا.
علم النفس النمائي
في معنى غير مرتبط نوعا ما بفروع علم الأحياء، يُستخدم مصطلح «علم الجينات الفوقي» في علم النفس النمائي لوصف النمو النفسي كنتيجة للتبادل مزدوج الاتجاه الجاري بين الوراثة والمحيط. نوقشت أفكار تفاعلية حول النمو في نماذج مختلفة وتحت مسميات مختلفة خلال القرنين التاسع عشر والعشرين. اقتُرح نموذج أولي بواسطة كارل إرنست فون باير وشهَّره إرنست هيكل. طُورت نظرة فوق جينية راديكالية (تخلق فوقي فيسيولوجي) بواسطة بول وينتربرت، وعُرض نموذج آخر (تخلق فوقي احتمالي) بواسطة غيلبرت غوتليب في 2003. وتشمل هذه النظرة جميع عوامل النمو الممكنة في كائنٍ وكيف أنها لا تؤثر على الكائن وبعضها البعض فحسب بل تؤثر كذلك على نموه.
كتب عالم النفس النمائي إريك إريكسون حول مبدأٍ فوق جيني في كتابه الهوية: الشباب والأزمة 1968 يشمل فكرة أننا ننمو ونتطور من خلال تكشُّفٍ لشخصيتنا في مراحل محددة مسبقا، وأن بيئتنا وثقافتنا المحيطة بنا تؤثر على كيفية تقدمنا عبر هذه المراحل. يحدث هذا التكشف البيولوجي المرتبط بالخلفيات الاجتماعية-الثقافية في مراحل من النمو النفسي الاجتماعي، أين «يُحدَّد التقدم نحو كل مرحلة بشكل جزئي بواسطة نجاحنا -أو فشلنا- في جميع المراحل السابقة».
رغم أن الدراسات التجريبية أظهرت نتائج متناقضة، يُعتقد أن التعديلات فوق الجينية هي آلية بيولوجية لصدمة منتقلة بين الأجيال.
الأساس الجزيئي
تعدِّل التغيرات فوق الجينية نشاط بعض الجينات، وليس تسلسل الشيفرة الجينية للدنا. يمكن أن تُعدَّل البنية الدقيقة للدنا في حد ذاته أو البروتينات المرتبطة به لتنشيط للجينات أو إسكاتها. تسمح هذه الآلية بتمايز الخلايا في الكائنات متعددة الخلايا للتعبير عن الجينات الضرورية لنشاطها فقط. يُحافظ على التغيرات فوق الجينية حين تنقسم الخلية، وتحدث معظم هذه التغيرات فوق الجينية خلال عمر الكائن الحي، لكن يمكن أن تنتقل التغيرات فوق الجينية إلى نسل الكائن عبر عملية تسمى الوراثة فوق الجينية عبر الأجيال. إذا ظهر تعطيل جين في النطفة أو البويضة التي تُحدث التخصيب، فإن ذلك التغيير فوق الجيني يمكن أن ينتقل كذلك إلى الجيل التالي.
تشمل العمليات فوق الجينية: الطفرات الزائفة، التعليم المرجعي، التطبع الجيني، إسكات الجين، تعطيل الصبغي X، تأثير الموضع، إعادة برمجة مثيلة الدنا، النقل البيني، التأثيرات الأمومية، تقدم التسرطن، التاثيرات العديدة للماسخات، تنظيم تعديلات الهستون والكروماتين المغاير، والحدود التقنية التي تؤثر على التوالد البكري والاستنساخ.
تضرر الدنا
يمكن لتضرر الدنا أن يُحدث تغيرات جينية كذلك. تضرر الدنا شائع جدا، ويحدث بمتوسط حوالي 60 ألف مرة في اليوم لكل خلية من جسم الإنسان (انظر تضرر الدنا الطبيعي) يتم إصلاح هذه الأضرار بالكامل تقريبا، لكن يمكن أن تبقى تغيرات فوق جينية في موقع ترميم الدنا. بالتحديد، يمكن لشرخ في سلسلة الدنا المزدوجة أن يبدأ إسكات جين فوق جيني غير مبرمج عبر التسبب في كل من مثيلة الدنا وتحفيز أنواع الإسكات المتعلقة بتعديل الهستون (تغيير بنية الكروماتين). فضلا على ذلك، يتراكم الإنزيم بوليميراز عديد الأدينوسين ثنائي الفوسفات ريبوز (Parp1) وناتجه عديد الأدينوسين ثنائي الفوسفات ريبوز (PAR) في مواقع تضرر الدنا كجزء من عملية الترميم. يدير هذا التراكم بدوره توظيف وتنشيط بروتين إعادة تغيير بينة الكروماتين ALC1 الذي يمكن أن يُحدث إعادة هيلكة للجسيم النووي. وُجد أن إعادة هيكلة الجسيم النووي تسبب إسكاتا فوق جيني لجين ترميم الدنا MLH1. تسبب المواد الكيميائية المضرة للدنا مثل البنزين، هيدروكينون، ستايرين، رباعي كلوريد الكربون وثلاثي كلورو الإيثيلين ضعف مثيلة الدنا، بعضها عبر تفعيل مسارات إجهاد تأكسدي.
معروف بأن الأغذية تغيِّر التأثيرات فوق الجينية للجرذان الذين يتناولون حميات غذائية مختلفة. بعض مكونات الأطعمة تزيد فوق جينيا مستويات إنزيمات ترميم الدنا مثل: O-6-ميثيل غوانين- ناقلة ميثيل الدنا (MGMT) وMLH1وبي53. بعض مكونات الأطعمة الأخرى يمكن أن تخفض تضرر الدنا مثل إيزوفلافون الصويا. في أحد الدراسات، انخفضت وسوم الإجهاد التأكسدي -مثل النوكليوتيدات المعدلة التي يمكن أن تسبب تضرر الدنا- بنظام تغذية يحتوي على فول الصويا مدته ثلاث أسابيع. لوحظ كذلك انخفاض تضرر الدنا التأكسدي بعد ساعتين من استهلاك مستخلس ثجير أويسة غني بالأنثوسيان (أويسية آسية).
تقنيات استخدمت لدراسة علم الجينات الفوقي
يُستخدم في دراسة علم الجينات الفوقي مجموعة متنوعة من التقنيات الجزيئية الحيوية وذلك لفهمٍ أفضلٍ لظاهرة فوق الجينات، ومنها: الترسيب المناعي للكروماتين (مع التقنيين البديلتين واسعتا النطاق شيب على شيب وشيب-سيك)، التهجين الموضعي المتألق، إنزيمات الاقتطاع الحساسة للمثيلة، تحديد ناقلة ميثيل أدينين الدنا وسلسلة بيكبريتيت . علاوة على ذلك، استخدام طرق المعلوماتية الحيوية له دور في علم الجينات الفوقي الحاسوبي.
الآليات
هناك عدّة آليات وراثيّة فوق جينيّة، لكن من الجدير بالذكر التنويه إلى أنّ بعضها ليس مقبولًا كليًّا في الأوساط العلميّة.
التعديلات التساهمية للحمض النوويّ والهستون
إنّ الكروماتين مكّون من الحمض النوويّ DNA بالإضافة إلى بروتينات الهستون المرتبطة به، فإذا اختلفت الطريقة التي يرتبط بها الحمض مع هذه البروتينات، قد يختلف تمظهر الجينات أيضًا، وتحدث التعديلات على الكروماتين من خلال طريقتين أساسيّتين:
- تعديلات ما بعد الترجمة Posttranslational modifications للأحماض الأمينيّة لبروتينات الهستون، ممّا يؤثّر على ارتباط الحمض النوويّ بها.
- إضافة مجموعات الميثيل الوظيفيّة للحمض النوويّ DNA ممّا يجعل المواقع الممثيلة أقلّ عرضةً لتمظهر جيناتها ويحدث عادةً للسلاسل المكرّرة في الحمض.
الحمض النوويّ الريبوزيّ RNA المنسوخ والبروتينات المشفّرة
تنتج بعض الجينات مركبات معينة تساعد على إبقاء نشاطها مستمرًّا، على سبيل المثال فإنّ Hnf4 و MyoD هي مركبات تساعد على تمظهر العديد من الجينات الخاصّة بنشاط الكبد والعضلات، ويعطي الحمض النوويّ الريبوزيّ إشارات تتضمن استدعاءً محددًا لمجموعة من البروتينات لتعديل الكروماتين أيضًا، وإنزيمات ناقلة لمجموعة الميثيل للحمض النوويّ DNA إلى مواقع محدّدة كما تقوم سلاسل مقتطعة من الحمض النوويّ الريبوزي بتغيّرات أخرى فوق جينية عن طريق تشكيل سلاسل مزدوجة من الحمض النوويّ الريبوزيّ RNA. وهذه التغيّرات سيتمّ وراثتها من قبل الجيل التالي حتى لو لم يعد المحفّز الأصلي لتنشيطها موجودًا، هذه الجينات تنشّط وتثبّط عادة عن طريق انتقال الإشارات Signal Transduction، لكنّها قد تنتقل أيضًا عبر الانتشار البسيط من خلال فراغات الفواصل Gap junctions بين الخلايا، وتورّث الأمّ جزءًا كبيرًا من الحمض النوويّ الريبوزيّ والبروتين للبويضة المخصّبة، ممّا ينتج تأثيرًا أموميًّا على الأنماط الظاهريّة، بينما ينتقل جزء صغير من الحمض النوويّ الريبوزيّ من الأبّ إلى البويضة المخصّبة، لكن هناك أدلّة جديدة تظهر بأنّنا نستطيع رؤية تغيّرات واضحة ناتجة من هذا الانتقال على مدى الأجيال المختلفة من الذرّيّة.
الأحماض النوويّة الريبوزيّة الدقيقة MicroRNAs
وهي مجموعة من من الأحماض غير المشفِّرة، تتراوح أطوالها بين 17 إلى 25 نيوكليوتيد، وتتحكّم بعمليّات حيويّة كثيرة في النباتات والحيوانات وقد تمّ اكتشاف 2000 نوع منها إلى عام 2013 في الجسم البشريّ وحده، وكل ّواحد من هذه الأحماض قد يستهدف 100-200 حمض ريبوزي رسول mRNA، حيث يكون مسؤولا عن تثبيطه ومعظم هذا التثبيط يحصل من خلال تحلّل الحمض الريبوزيّ الرسول المُستهدَف، لكنّ البعض الآخر يحدث في مرحلة ترجمة الحمض إلى بروتينات. ويبدو لنا أنّ هذه الأحماض الدقيقة (التي يتم التحكّم بها بطريقة فوق جينيّة) تتحكّم بأكثر من 60% من الجينات المشفّرة التي تتمظهر ثمّ تترجم إلى بروتينات، ومن الطرق المقترحة لكيفيّة تثبيط هذه الأحماض فوق جينيًا هي المثيلة لل CpG islands المرتبطة بهذه الأحماض، بالإضافة إلى وجود أحماضٍ أخرى يتمّ تثبيطها عن طريق تعديلات الهستون أو مثيلة الحمض النوويّ DNA المركبة.
الحمض النوويّ الريبوزيّ الرسول
في عام 2011، تمّتِ البرهنة على أنّ مثيلة هذا الحمض تلعب دورًا مهمًّا جدًا في التوازن الحراريّ في الجسم البشريّ، كما أنّ الجين المرتبط بالسّمنة (FTO gene) يُحدث تغييرات على مستوى هذا الحمض.
الأحماض النوويّة الريبوزيّة الصغيرة RNAs
وهي أحماض صغيرة، يترواح طولها بين 50-250 نيكليوتيد، وهي غير مشفّرة وتتواجد في البكتيريا، وظيفتها الرئيسية هي التحكّم بتمظهر الجينات، ويُنظر لها كأداة فاعلة في الصراع مع البكتيريا المقاومة للأدوية المتاحة وتلعب دورًا مهمًّا في الكثير من العمليّات الحيويّة مثل الارتباط بالحمض النوويّ الريبوزيّ الرسول والبروتينات في غير حقيقات النواة (Prokaryotes).
البريونات Prions
وهي بروتينات مُعدِيَة، تخرج عن الوظيفة الأساسية للبروتينات التي تقوم بوظائف خلويّة محدّدة، حيث تستطيع تحويل الأشكال الأصليّة للبروتينات إلى شكل آخر مُعْدٍ ومُؤذٍ، وتُعتَبر بهذه الصورة عاملٌ فوق جينيّ يستطيع إحداث تغيير للنمط الظاهري دون تغيير في الجينوم. ويَعتبِر البعض أنّ البريونات الفطريّة عواملًا فوق جينيّة لأنّ النمط الظاهري المعدي منها قد يتمّ وراثته دون تعديل في الجينوم، ويُعتَبر البروتينان (PSI+) و (URE3) اللذان اكتُشِفا في الخميرة عامي 1965 و 1971 أفضل مثالين على هذا النوع من البريونات وتعمل هذه البريونات من خلال تحطيم البروتينات المتجمّعة، مقلّلة من نشاطها. وفي الخلايا التي تحتوي على البروتين PSI+ يحدث خلل في البروتين Sup35 مسبّبا معدلًا أعلى من القراءة لدى الرايبوسومات لشيفرة التوقّف.
أنظمة الوراثة البنائيّة
حيث تُستخدَم البناءات الموجودة للخلايا لصناعة بناءات جديدة في الأجيال القادمة، أمّا الآليات فما زالت بعد غير واضحة للآن.
تموقع الأجسام النوويّة
يتمّ تعليب الجينوم (packaging) بمساعدة الأجسام النوويّة، وتموقع هذه الأجسام ليس عشوائيًا، بل يحدّد إمكانية وصول الحمض النوويّ DNA للبروتينات الناظمة والمتحكّمة، وهذا يحدّد الاختلافات في تمظهر الجينات وتمايز الخلايا، ويتمّ استبقاء بعض الأجسام النوويّة هذه في خلايا الحيوان المنوي. وهكذا، فإنّ تموقع هذه الأجسام قابل للوراثة نسبيًا، وأفادت دراسات حديثة أنّ هناك علاقة بين هذا التموقع وبعض العوامل فوق الجينيّة الأخرى، كمثيلة الحمض النوويّ DNA.
الوظائف والعواقب (Functions and consequences)
النموّ (Development)
الوراثة فوق الجينيّة خاصّة عن طريق التعديلات التساهميّة بين الحمض النوويّ DNA والهيستون وتموضع الأجسام النوويّة، هي مهمّة جدًا في تطوّر الكائنات الحيّة متعدّدة الخلايا. إنّ التعديلات فوق الجينية تتحكّم مثلًا بتحوّل الخلايا الجذعية العصبية إلى خلايا دبقية (Glial cells)عن طريق مثيلة الهستون. أمّا النباتات فتتأثر أيضًا بعوامل وعمليّات فوق جينيّة كتعديل الكروماتين، لكنّ بعضها لا يحتاج أو يستخدم «ذاكرة خلوية»، بل تستخدم المعلومات الموقعيّة من البيئة والمحيط من حولها لتحدّد مصيرها.
يتم تقسيم علم ما فوق الجينات إلى تخلّق محدّد مسبقًا، وتخلّق محتمل. أمّا الأول فهو طريق ذو اتجاه واحد من التطوّر البنائيّ للحمض النوويّ DNA إلى النضج الوظيفيّ للبروتينات الناتجة، أمّا النوع الثاني (المحتمل)، فهو طريق تطوّر ذو اتجاهين بين البناء والوظيفة.
الطبّ
لعلم ما فوق الجينات تطبيقات متنوعة في عالم الطبّ ومن الواضح مثلًا أن لهذا العلم دورًا في فهم الأمراض الجينيّة الخلقيّة، كأمراض Angelman syndrome و Prader-Willi syndrome حيث يتسبّب إلغاء أو تثبيط بعض الجينات في هذين المرضين، لكنّ الغريب هو أنّ هذين المرضين شائعان على غير المتوقع، وما يفسرّ لنا هذا الشيوع هو كون الأفراد المصابين فرادنيّي الزيجوت (Hemizygous) بسبب عمليّة تطبع الجينات (Genomic imprinting)التي هي عمليّة فوق جينيّة بالأساس.
التطوّر (Evolution)
من الممكن للعوامل فوق الجينيّة أن تؤثر في التطوّر إذا كانت وراثيّة، واختلف علماء البيولوجيا بين مطالب بتطوير الإطار التصوريّ الأساسيّ للبناء التطوريّ الحديث (modern evolutionary synthesis) وبين من ضمّ الوراثة فوق الجينيّة إلى التصوّر الجينيّ السكانيّ (Population genetics) وبين مَنْ ظلّ متشككًا وفاتحًا للاحتمالات على مصراعيها. هناك فرقان أساسيان تختلف بهما الوراثة فوق الجينيّة عن الجينيّة، مع عواقب مهمّة بالنسبة للتطوّر، وهما أنّ معدّل الطفرات فوق الجينيّة أعلى، وأنّ إمكانيّة الرجوع عنها أسهل. في النباتات، طفرات مثيلة الحمض النوويّ تحدث بمعدل 100000 مرّة أكثر من الطفرات الجينيّة.
اكتشافات بحثيّة حديثة وأمثلة على التأثيرات
تمّ ملاحظة بعض التغيّرات فوق الجينيّة لدى التعرّض لمؤثرات بيئيّة معيّنة. فمثلا، تغيّر لون فرو بعض الفئران وأوزانهم وقابليتهم لنشوء السرطان في أجسادهم لدى تعرّضهم لحميّة غذائيّة معيّنة، من خلال تنشيط جين معيّن Agouti gene.
كما أنّ هناك دراسة تقول بأنّ الأحداث الصّادمة قد تولّد مشاعر خوف تُمَرّر للأجيال القادمة عن طريق العوامل فوق الجينيّة مثلاً، أفادت دراسة على الفئران عام 2013 أنّ الفئران قد تنتج ذرّية لديها نفور عامّ من أدوات معيّنة؛ لأنّها كانت مصدرًا لتجارب سيئة لأجدادهم أو آبائهم. لكنّ الدراسة السابقة واجهت عدّة انتقادات، منها التحيّز في رصد النتائج بسبب الجودة الإحصائيّة المنخفضة للدراسة كما أنّ عدد الفئران في التجربة قليل لكي يتمّ تعميم النتيجة على البقيّة.
أمّا في البشر، فلم يجد الباحثون فرقًا في التوائم المتطابقين (المتعرضين لتأثير بيئي مختلف) في سنين حياتهم الأولى، لكنّ الفرق فوق الجيني اتّضح عندما كبروا قليلًا، حيث ظهر الاختلاف في مثيلة الحمض النوويّ وتعديلات الهستون، وكان التوائم الذين قضوا أقلّ وقت مع بعضهم هم الأكثر اختلافًا على الصعيد فوق الجينيّ. تمّ تسجيل أكثر من 100 ظاهرة وراثة فوق جينيّة عبر الأجيال في طيف واسع من الكائنات الحية (وحيدات الخلايا، النباتات، الحيوانات) على سبيل المثال، تغيّر فراشات Mourning Cloack لونها من خلال تغيّرات معينة في الهرمونات نتيجة تعرّضها لدرجات حرارة مختلفة. كما أظهرت دراسات حديثة إن الإنزيماتنازعات الأمين من عائلة APOBEC/AID من الممكن أن تؤثّر في الوراثة الجينيّة وفوق الجينيّة بشكل متزامن، باستخدام آليات جزيئيّة مشابهة.
تأثيرات فوق جينيّة في البشر
تطبّع الجينوم والاضطرابات المتعلقة به (Genomic imprinting and related disorders)
وهي ظاهرة في الثدييات حيث يقوم كل من الأبّ والأمّ بتوريث نمط فوق جينيّ مختلف لمواقع معينة في الجينوم في خلاياهم الجنسيّة وأفضل مثالين على ذلك هما: Angelman syndrome و Prader-Willi syndrome. حيث ينتجان بسبب نفس الطفرة الجينية في الكروموسوم الخامس عشر، أمّا الاضطراب الناتج فيعتمد على مصدر الطفرة الموروثة، من الأبّ أو من الأمّ وهذا بسبب وجود تطبّع للجينوم في تلك المنطقة منه. أمّا Beckwith-Wiedmann syndrome فهي ناتجة من تطبّع في الجينوم في الكروموسوم الحادي عشر وهي موروثة من ناحية الأمّ.
مشاهدات فوق جينية عبر الأجيال
في دراسة «أوفركاليكس» لاحظ ماركوس بيمبري وزملاؤه أنّ الأحفاد من جهة الأبّ (وليس الذين من جهة الأمّ) للرجال السويديين الّذين تعرّضوا وهم صغار للمجاعة في القرن التاسع عشر، هم أقلّ عُرضة للموت نتيجة مرض في القلب، أمّا لو كان الطعام موجودًا بكثرة، فقد رأوا زيادة ملاحظة لنسب الموت بسبب السكّري لدى الأحفاد، وهذا قد يعطينا دليلًا على تغيّر فوق جينيّ موروث. وعلى عكس ذلك، فقد وجدوا أنّ الحفيدات من جهة الأبّ (وليس اللواتي من جهة الأمّ) للنساء السويديات اللواتي تعرّضن للمجاعة وهنّ ما زالوا في الرّحم، عاشوا حياة أقصر كمعدّل عام.
السرطان والشذوذات التطوّرية
ثمّة العديد من المركبات التي تعتبر مسرطنات فوق جينيّة، حيث تقوم هذه المركبات بزيادة معدّل حدوث السرطان دون أن تُحدث طفرة جينيّة مباشرة، ومن هذه المركبات: ثنائي-إيثيل الستيلبيسترول (Diethylstilbestrol)، الأرسينيت (Arsenite)، سداسي كلوروالبنزين (Hexachlorobenzene)، مركبات النيكل (Nickel compunds). الكثير من الماسخات (teratogens) تؤثّر على الأجنّة عبر آليات فوق جينيّة. من الممكن أن يظلّ هذا الأثر ويستمرّ طوال حياة الطفل المتأثّر، لكنّ إمكانية أن تنتج تشوّهات خلقيّة نتيجة تعرّض الآباء أو في الجيل الثاني من الذرّية رُفضت نظريًا ونتيجة نقص الأدلّة عليها. منظمة الأغذية والأدوية الأمريكية صنّفت دواء (Vidaza) وهو أحد مركبات ال azacitidine، كدواء خطر على الرجال الآباء، وتحذّر من أنّ تناوله يجب ألّا يترافق مع الاقتراب الشديد من الطفل؛ لأنّ تجاربًا على الفئران أثبتت أنّ هذا يقلّل من الخصوبة ويزيد من إمكانيّة إسقاط الجنين، والشذوذات التطوريّة. في الفئران، تمّ رصد اختلافات في نشاط الغدد الصمّ في الذكور المعرّضين للمورفين، وفي الفئران أيضًا، تمّ رصد تغيّرات فوق جينيّة في الجيل الثاني نتيجة التعرّض لثنائي-إيثيل الستيلبيسترول. وتُظهِر دراسات حديثة أنّ ارتباط جين MLL مع جينات أخرى في كروموسومات أخرى يسبّب سرطان الدم (اللوكيميا)، ونعرف أنّ هذا الارتباط يقع تحت سيطرة فوق جينية. كما نتج عن دراسات أخرى أن سرطان البروستات قد يكون مرتبطًا ومتأثرًا بأستلة الهستون (Histone acetylation) ومثيلة الحمض النوويّ DNA، وهي عمليّات فوق جينيّة كما أنّ تمظهر الجينات في البروستات يمكن التحكّم به نسبيًا عن طريق نوعيّة الغذاء المتناول وطريقة الحياة.
مثيلة الحمض النوويّ DNA في السرطان
مثيلة الحمض النوويّ هو عامل متحكّم ومهمّ بتمظهر الجينات، كما أنّ هناك أدلّة متزايدة تؤكّد ارتباطه بإخماد الجينات، حيث أنّ الجينات الغنيّة بمركب 5-ميثيل سيتوسين (5-methylcytosine) تكون مُخمَدة، مثيلة الحمض النووي أيضًا عمليّة مهمّة جدًا لتطوّر الجنين، والشذوذات الموجودة في عمليّة المثيلة هذه تمّ ربطها بالعديد من السرطانات، وهي تأتي على شكلين: مثيلة أكثر من اللازم، ومثيلة أقلّ من اللازم، وكلاهما يؤثّر في تطوّر السرطان عبر آليات مختلفة ومتنوعة.
مُصلِحات الحمض النوويّ والسرطان وما فوق الجينات
إنّ السرطانات التي تحدث نتيجة طفرات في ال Germ lines في الجينات المصلحة للحمض النوويّ، والتي تصنّف أمراضًا عائلية (familial) تشكّل فقط جزءًا صغيرًا من حالات السرطان. أمّا التغيّرات فوق الجينية التي تحدث تقليلًا في تمظهر الجينات المصلحة للحمض النوويّ، فهي شائعة جدًا في الحالات الفُراديّة من السرطانات بينما تقلّ الطفرات الجينيّة المباشرة في هذه الحالات، كما هو موضّح حسب الجدول التالي:
| المرجع | معدّل الحدوث | التغير فوق الجيني | الجين | السرطان |
| 13% | CpG island مثيلة | BRCA1 | الصدر | |
| 17% | CpG island مثيلة | WRN | ||
| 36% | CpG island مثيلة | WRN | المبيض | |
| 5%–30% | CpG island مثيلة | BRCA1 | ||
| 21% | CpG island مثيلة | FANCF | ||
| 3% | CpG island مثيلة | RAD51C | ||
| 40%–90% | CpG island مثيلة | MGMT | القولون والمستقيم | |
| 38% | CpG island مثيلة | WRN | ||
| 2%–65% | CpG island مثيلة | MLH1 | ||
| 13% | CpG islandمثيلة | MSH2 | ||
| 100% | غير معروف | ERCC1 | ||
| 55% | غير معروف | Xpf | ||
| 35%–57% | CpG island مثيلة | MGMT | الرأس والرقبة | |
| 27%–33% | CpG island مثيلة | MLH1 | ||
| 62% | CpG island مثيلة | NEIL1 | ||
| 46% | CpG island مثيلة | FANCB | ||
| 46% | CpG island مثيلة | MSH4 | ||
| 25% | CpG island مثيلة | ATM |
إنّ المشكلة الرئيسيّة في إحداث خلل في الجينات المصلحة للحمض النوويّ أنّه يسبّب عدم استقرار للجينوم، وهذا هو السبب الرئيسي للتغييرات الجينيّة التي تقود إلى السرطان.
هستون H2A والسرطان
هذا الهستون مهمّ جدًا في الثديات، حيث يلعب أدوارًا عدّة في العمليّات الخلويّة داخل النواة، وأحد أفراد هذه العائلة هو الهستون H2A.X الذي يدلّ على وجود خلل في شريط الحامض النوويّ، وله دور في عملية تصحيح الخلل، ويرتفع هذا الهستون في بعض أنواع السرطانات ويرتبط وجوده بوجود خلل في استقرار جينوم الخلية، وهو مهمّ جدًا في تطوّر الكثير من السرطانات، مثل سرطان الكبد.(156)
علاج السرطان
بعض الأبحاث الحديثة تظهر لنا أنّ المستحضرات الدوائيّة فوق الجينيّة قد تكون بديلًا أو علاجًا مضافًا لطرق العلاج التي نستخدمها حاليًا كالإشعاع والعلاج الكيماوي، وإنّ التحكّم بالهستون وأشكاله المختلفة يؤثّر مباشرة على تكون السرطان وتطوّره من عدمه كما إنّ العلاج فوق الجينيّ يمتلك أيضًا خاصيّة مميزة وهي إمكانيّة الرجوع عنه على عكس جميع العلاجات الأخرى. تطوّر البحث في هذه الأدوية استهدف بشكل رئيسيّ الإنزيمات الناقلة للأسيتيل والتي ترتبط بالهستون (Histone acetyltransferase)، وكذلك نازعات الأسيتيل من الهستون (Histone deacetylase)(123)، حيث إنّ الإنزيم الأخير له دور حاسم في تطوّر سرطان الفمّ. ومن الإنزيمات المرشّحة حاليًا لاستهدافها بالعلاج هي ناقلات مجموعة الميثيل المرتبطة بالهستون (Histone lysine methyltranserase) وناقلات الميثيل المرتبطة بالبروتين والأرجينين (protein arginine methyltransferase) .
دراسات التوائم
أظهرت دراسات حديثة على التوائم المتطابقين وغير المتطابقين أدلّة على تأثير فوق جيني في البشر فمِن الممكن أنّ الاختلاف في البيئة يسبّب تأثيرات فوق جينيّة طويلة الأمد، وتطوّرًا مختلفًا. ويبدو أنّ عامل العمر مهمّ جدًا لتراكم الاختلافات فوق الجينيّة بين الأخوين. وأفادت دراسة حديثة على 114 توأم متطابق و80 توأم غير متطابق أنّ انقسامًا متشابهًا للكيسة الأريمية (Blastocyst) بين الأخوين ينتج تشابهًا في الصفات فوق الجينيّة، أي أنّ البيئة الدقيقة المحيطة بالجنين في المرحلة المبكّرة من حياته في الرّحم قد تكون مهمّة جدًا للتأثيرات فوق الجينيّة.
علم ما فوق الجينات في الكائنات الحيّة الدقيقة
لدى البكتيريا العديد من العمليّات فوق الجينيّة المشابهة، مثل مثيلة الحمض النوويّ DNA لكن مع بعض الاختلافات في الحمض النوويّ الممثيل (الأدينين بدل السيتوسين) مثيلة الأدينين تعطي إشارةً للتكاثر، وإصلاح الأخطاء، والتحكّم بتمظهر الجينات.
ثمّة العديد من المشاريع التي أظهرت قدرتنا على جمع المعلومات فوق الجينيّة من البكتيريا.
في الثقافة الشعبيّة
تمّ ذكر علم ما فوق الجينات وتقنيات التحكّم به المستخدمة من قبل البشر للنجاة واستمرار الجنس البشريّ في الحياة، في روايّة للكاتب نيل ستيفنسون، الصادرة عام 2015 واسمها "Seveneves" حيث جاء فيها أنّ البشر ينجون من الأخطار بواسطة عمليّة فوق جينيّة تدعى “going epi”.
ملاحظات
انظر أيضًا
المراجع
وصلات خارجية
- The Human Epigenome Project (HEP)
- The Epigenome Network of Excellence (NoE)
- Canadian Epigenetics, Environment and Health Research Consortium (CEEHRC)
- The Epigenome Network of Excellence (NoE)- public international site
- DNA Is Not Destiny – Discover Magazine cover story
- BBC – Horizon – 2005 – The Ghost In Your Genes
- Epigenetics article at Hopkins Medicine
- Towards a global map of epigenetic variation
| لمحة عامة |
|
||||||
|---|---|---|---|---|---|---|---|
| هندسة |
|
||||||