مغنيسيوم في علم الأحياء
المغنيسيوم عنصر أساسي في الأنظمة الحيوية. ويتواجد المغنيسيوم عادةً على شكل أيون المغنيسيوم (Mg2+). هو عنصر غذائي معدني أساسي للحياة ويتواجد في جميع أنواع الخلايا في كل الكائنات الحية. على سبيل المثال، يجب أن يرتبط الأدينوسين ثلاثي الفوسفات (ATP)، وهو المصدر الرئيسي للطاقة في الخلايا، بأيون المغنيسيوم حتى يصبح نشطًا حيوياً. ما يسمى ATP غالباً ما يكون في الواقع مغنيسيوم-ثلاثي فوسفات الأدينوسين (Mg-ATP). على هذا النحو، يلعب المغنيسيوم دورًا في استقرار جميع مركبات متعدد الفوسفات في الخلايا، بما في ذلك تلك المرتبطة ببناء الحمض النووي الريبوزي (RNA) والحمض النووي الريبوزي منقوص الأكسجين (DNA).
هناك أكثر من 300 إنزيم يستلزم عملها التحفيزي وجود أيونات المغنسيوم، منها جميع الإنزيمات التي تستخدم ثلاثي فوسفات الأدينوسين أو تقوم ببنائه، أو تلك التي تستخدم نيوكليوتيدات أخرى لبناء الحمض النووي الريبوزي والحمض النووي الريبوزي منقوص الأكسجين.
في النباتات، يُعتبر المغنيسيوم ضروريًا لتصنيع الكلوروفيل والبناء الضوئي.
الوظيفة
توازن المغنيسيوم أمر حيوي أساسي لسلامة جميع الكائنات الحية. المغنيسيوم أيون وفير نسبياً في طبقتيّ القشرة الأرضية والستار وهو متوافر حيوياً بدرجة عالية في الغلاف المائي. هذا التوافر، بالاقتران مع الكيمياء المفيدة وغير المألوفة للغاية، قد يؤدي إلى استخدامها في تطور الأيون من أجل تبادل الإشارات، وتنشيط الإنزيمات، والتحفيز. ومع ذلك، فإن الطبيعة غير العادية للمغنيسيوم الأيوني قد تؤدي أيضا إلى تحدٍّ كبير في استخدام الأيون في الأنظمة الحيوية. الأغشية الحيوية غير منفذه للمغنيسيوم (وأيونات أخرى)، وبالتالي، يجب على البروتينات الناقلة أن تسهل من تدفق المغنيسيوم من وإلى الخلايا والحجرات البين خلوية.
الكلوروفيل الموجود في النباتات يحول الماء إلى أكسجين (O2). الهيموجلوبين في الحيوانات الفقارية ينقل الأكسجين (O2) في الدم. ويتشابه الكلوروفيل إلى حد كبير مع الهيموجلوبين، باستثناء أن المغنسيوم يكون في مركز جزيء الكلوروفيل بينما يكون الحديد في مركز جزيء الهيموجلوبين، بالإضافة إلى اختلافات أخرى. تحافظ هذه العملية على حياة الخلايا على الأرض وتحافظ على المستويات الأساسية لثاني أكسيد الكربون (CO2) والأكسجين (O2) في الغلاف الجوي.
صحة الإنسان
للمزيد من المعلومات: نقص مغنيسيوم الدم.
يؤدي نقص تناول المغنيسيوم في كثير من الأحيان إلى تشنجات عضلية، ونقصه مرتبط أيضاً بأمراض القلب والأوعية الدموية، والسكري، وارتفاع ضغط الدم، واضطرابات القلق، والصداع النصفي، وهشاشة العظام، واحتشاء الدماغ. النقص الحاد (انظر: نقص مغنسيوم الدم) نادر الحدوث، وهو أكثر شيوعًا كأثر جانبي للأدوية (مثل تعاطي الكحول المزمن أو استخدام مدر البول) منه بسبب انخفاض تناول الطعام في حد ذاته، ولكن يمكن أن يحدث عند الأشخاص الذين يتغذون عن طريق الوريد لفترات طويلة من الزمن.
أكثر الأعراض شيوعًا للإفراط في تناول المغنيسيوم عن طريق الفم هو الإسهال. المكملات التي تعتمد على مخلّبات الأحماض الأمينية (مثل الجلايسينات والليسينات وما إلى ذلك) يتحملها الجهاز الهضمي بشكل أفضل وليس لها آثار جانبية كتلك التي كانت في المركبات القديمة المستخدمة، بينما تمنع المكملات الغذائية التي تُدخَل إلى الجسم بكميات قليلة ومستمرة حدوث الإسهال. نظرًا لأن الكلى عند البالغين تفرز المغنيسيوم الزائد بكفاءة، فإن التسمم الفموي بالمغنيسيوم عند البالغين الذين لديهم وظائف كلوية طبيعية نادر جدًا. أما الرُّضع فلا ينبغي إعطائهم مكملات المغنيسيوم إلا بإشراف الطبيب، وذلك لأن قدرتهم على إفراز المغنيسيوم الزائد تكون أقل حتى وإن كانوا بصحة جيدة.
تُستخدم المستحضرات الصيدلانية التي تحتوي على المغنيسيوم في علاج حالات نقص المغنيسيوم ونقص مغنسيوم الدم، وكذلك تسمم الحمل. عادةً ما تكون هذه المستحضرات على شكل كبريتات المغنيسيوم أو كلوريد المغنيسيوم عندما تعطى بالحقن. يمتص الجسم المغنيسيوم من أي ملح مغنيسيوم قابل للذوبان (مثل: كلوريد المغنيسيوم أو سترات المغنيسيوم) بكفاءة مقبولة (30% إلى 40%). يُمتص المغنيسيوم من الملح الإنجليزي (كبريتات المغنيسيوم) بطريقة مشابهة، على الرغم من أن الكبريتات الموجودة في هذا الملح تزيد من تأثيره المُلَيِّن عند إعطاؤه بجرعات عالية. امتصاص المغنيسيوم من أملاح أكسيد المغنيسيوم وهيدروكسيد المغنيسيوم غير القابلة للذوبان غير منتظم وذو كفاءة أقل، لأنه يعتمد على معادلة الملح وحله بواسطة حمض المعدة، والذي قد لا يكون كاملاً (وعادةً لا يكون كاملاً).
يمكن استخدام أوروتات المغنيسيوم كعلاج مساند في المرضى الذين يتلقون العلاج الأمثل لفشل القلب الاحتقاني الشديد، لزيادة معدل البقاء وتحسين الأعراض السريرية وجودة حياة المريض.
التوصيل العصبي
يمكن أن يؤثر المغنيسيوم على انبساط العضلات من خلال التأثير المباشر على الأغشية الخلوية. تغلق أيونات المغنيسيوم (Mg2+) أنواعًا معينة من قنوات الكالسيوم، والتي تنقل أيونات الكالسيوم موجبة الشحنة إلى الخلايا العصبية. مع وجود فائض من المغنيسيوم، ستغلَق المزيد من القنوات وسيقل نشاط الخلية العصبية.
ارتفاع ضغط الدم
تُستَخدم كبريتات المغنيسيوم على شكل حُقَن في الوريد لعلاج مقدمة تسمم الحمل. بالنسبة لارتفاع ضغط الدم غير المرتبط بالحمل، فقد كانت خلاصة تحليل إحصائي تكاملي ل 22 تجربة سريرية بنطاقات جرعة تتراوح من 120 إلى 973 مليغرام/ يوم وبجرعة متوسطة 410 مليغرام، أن مكملات المغنيسيوم كان لها تأثير صغير ولكنه ذو دلالة إحصائية، حيث خفض ضغط الدم الانقباضي بمقدار 3-4 مليمتر زئبقي وضغط الدم الانبساطي بنسبة 2-3 مليمتر زئبقي. كان التأثير أكبر عندما كانت الجرعة أكثر من 370 مليغرام/ يوم.
مرض السكري وتحمل الغلوكوز
إن تناول كميات أكبر من المغنيسيوم في النظام الغذائي يتوافق مع انخفاض الإصابة بمرض السكري. بالنسبة للأشخاص المصابين بداء السكري أو المعرضين لخطر الإصابة به، فإن مكملات المغنيسيوم تقلل نسبة السكر الصيامي.
التوصيات الغذائية
قام المعهد الأمريكي للطب (IOM) بتحديث متوسط الاحتياجات المقدرة (EARs) والمخصص الغذائي المقتَرَح (RDAs) للمغنيسيوم في عام 1997. إذا لم تكن هناك معلومات كافية لإنشاء متوسط الاحتياجات المقدرة والمخصص الغذائي المقترح، يُستخدم بدلاً من ذلك تقدير معين لكمية غذائية مرجعية (AI). يبلغ متوسط احتياجات المغنيسيوم المقدرة للنساء والرجال الذين تبلغ أعمارهم 31 عاماً فأكثر 265 مليغرام/ يوم و 350 مليغرام/ يوم على التوالي. أما المخصص الغذائي المقترح للمغنيسيوم 320 مليغرام/ يوم للنساء و 420 مليغرام/ يوم للرجال. المخصص الغذائي المقترح أعلى من متوسط الاحتياجات المقدرة، وذلك لتحديد المبالغ التي ستغطي الأشخاص بمتطلبات أعلى من المتوسط. المخصص الغذائي المقترح للحمل هو 350 إلى 400 مليغرام/ يوم اعتماداً على عمر المرأة. المخصص الغذائي المقترح للإرضاع يتراوح من 310 إلى 360 مليغرام/ يوم لنفس السبب. بالنسبة للأطفال الذين تتراوح أعمارهم من 1 إلى 13 عامًا، يزيد المخصص الغذائي المقترح مع تقدم العمر من 65 إلى 200 مليغرام/يوم. فيما يتعلق بالسلامة، يحدد المعهد الأمريكي للطب المستوى الأعلى من كمية الاستهلاك المسموح بها (ULs) من الفيتامينات والمعادن عندما تكون الأدلة كافية. بالنسبة للمغنيسيوم، فإن المستوى الأعلى من كمية الاستهلاك المسموح بها 350 مليغرام/ يوم. وهذا المستوى خاص بالمغنيسيوم المستهلك كَمُكَمِّل غذائي، والسبب هو أن تناول الكثير من المغنيسيوم في وقت واحد يمكن أن يسبب الإسهال. لا ينطبق المستوى الأعلى من كمية الاستهلاك المسموح بها على المغنيسيوم المُستهلك من المصادر الغذائية. بشكل جماعي، يُشار إلى متوسط الاحتياجات المقدرة والمخصص الغذائي المقترح والمستوى الأعلى من كمية الاستهلاك المسموح بها باسم كمية غذائية مرجعية.
| العمر | ذكر | أنثى | الحمل | الإرضاع |
|---|---|---|---|---|
| منذ الولادة حتى 6 أشهر | 30 مليغرام* | 30 مليغرام* | ||
| 7- 12 شهر | 75 مليغرام* | 75 مليغرام* | ||
| 1- 3 سنة | 80 مليغرام | 80 مليغرام | ||
| 4- 8 سنة | 130 مليغرام | 130 مليغرام | ||
| 9- 13 سنة | 240 مليغرام | 240 مليغرام | ||
| 14- 18 سنة | 410 مليغرام | 360 مليغرام | 400 مليغرام | 360 مليغرام |
| 19- 30 سنة | 400 مليغرام | 310 مليغرام | 350 مليغرام | 310 مليغرام |
| 31- 50 سنة | 420 مليغرام | 320 مليغرام | 360 مليغرام | 320 مليغرام |
| أكثر من 51 سنة | 420 مليغرام | 320 مليغرام |
*= كمية كافية
تشير الهيئة الأوروبية لسلامة الأغذية (EFSA) إلى مجموعة المعلومات الجماعية على أنها قيم مرجعية غذائية، مع كمية استهلاك السكان المرجعية (PRI) بدل المخصص الغذائي المقترح، ومتوسط الاحتياجات بدل متوسط الاحتياجات المقدرة. أما الكمية الغذائية المرجعية والمستوى الأعلى من كمية الاستهلاك المسموح بها فهم كما في الولايات المتحدة. بالنسبة للنساء والرجال الذين تبلغ أعمارهم 18 عامًا أو أكثر، فإن كمية الغذاء المرجعية تُضبط على 300 و350 مليغرام/ يوم، على التوالي. كمية الغذاء المرجعية للحمل والإرضاع أيضاً 300 مليغرام/ يوم. بالنسبة للأطفال الذين تتراوح أعمارهم من 1 إلى 17 عامًا، تزيد كمية الغذاء المرجعية مع تقدم العمر من 170 إلى 250 مليغرام/ يوم. كميات الغذاء المرجعية هذه أقل من المخصص الغذائي المقترح الأمريكي. أعادت الهيئة الأوروبية لسلامة الأغذية النظر في سؤال السلامة، وحددت المستوى الأعلى من كمية الاستهلاك المسموح بها عند 250 مليغرام/ يوم - أقل من قيمة الولايات المتحدة الأمريكية. يُعتبر المستوى الأعلى من كمية الاستهلاك المسموح بها للمغنيسيوم فريداً حيث أنه أقل من بعض المخصصات الغذائية المقتَرَحة. وينطبق هذا على الكمية المستهلكة من العامل الدوائي أو المكملات الغذائية فقط، ولا يشمل الكمية المستهلكة من الطعام والماء.
لأغراض وسم الأغذية أو المكملات الغذائية في الولايات المتحدة الأمريكية، يُعبّر عن الكميّة في الحصة كنسبة مئوية من القيمة اليومية. لأغراض وسم المغنيسيوم كانت 100% من القيمة اليومية 400 مليغرام، ولكن اعتبارًا من 27 مايو 2016 عُدِّلت إلى 420 مليغرام لجعلها متوافقة مع المخصص الغذائي المقترح. كان الالتزام بلوائح الملصقات المحدثة مطلوبًا بحلول 1 يناير 2020، للشركات المصنعة التي تبلغ مبيعاتها السنوية من الأغذية 10 ملايين دولار أو أكثر، وبحلول 1 يناير 2021، للمصنعين الذين تقل مبيعاتهم الغذائية السنوية عن 10 ملايين دولار. خلال الأشهر الستة الأولى التي تلي تاريخ الامتثال في 1 يناير 2020، تخطط إدارة الغذاء والدواء للعمل بشكل تعاوني مع الشركات المصنعة لتلبية متطلبات بطاقة المادة الغذائية الجديدة ولن تركز على إجراءات الإنفاذ فيما يتعلق بهذه المتطلبات خلال تلك الفترة. يتوفر جدول بالقيم اليومية المرجعية القديمة والجديدة للبالغين.
الخضار الخضراء مثل السبانخ توفر المغنيسيوم بسبب وفرة جزيئات الكلوروفيل التي تحتوي على الأيون. المكسرات (وخاصة الجوز البرازيلي والكاجو واللوز) والبذور (مثل بذور اليقطين) والشوكولاتة الداكنة وفول الصويا المحمص والنخالة وبعض الحبوب الكاملة هي أيضًا مصادر جيدة للمغنيسيوم.
على الرغم من احتواء العديد من الأطعمة على المغنيسيوم، إلا أنه يوجد عادة بنسب منخفضة. كما هو الحال مع معظم العناصر الغذائية، من غير المرجح تلبية الاحتياجات اليومية للمغنيسيوم بحصة واحدة من أي طعام واحد. سيساعد تناول مجموعة متنوعة من الفاكهة والخضروات والحبوب على ضمان تناول كمية كافية من المغنيسيوم.
لأن المغنيسيوم يذوب بسهولة في الماء، فإن الأطعمة المكررة، التي غالبًا ما تُعالج أو تُطهى في الماء ثم تُجفَّف، بشكل عام، هي مصادر فقيرة بالعناصر الغذائية.
على سبيل المثال، يحتوي خبز القمح الكامل على ضعف كمية المغنيسيوم الموجودة في الخبز الأبيض لأن النخالة والبذرة الغنية بالمغنيسيوم تُزال عند معالجة الدقيق الأبيض. يشير جدول المصادر الغذائية للمغنيسيوم إلى العديد من المصادر الغذائية للمغنيسيوم.
يمكن للمياه "العسرة" أيضًا أن توفر المغنيسيوم، لكن الماء «اللين» يحتوي على كمية أقل من الأيون. لا تقوم المسوحات الغذائية بتقييم كمية المغنيسيوم المستهلكة من الماء، مما قد يؤدي إلى التقليل من إجمالي استهلاك المغنيسيوم وتنوعه.
قد يجعل الكثير من المغنيسيوم من الصعب على الجسم امتصاص الكالسيوم.
عدم الحصول على كمية كافية من المغنيسيوم قد يؤدي إلى نقص مغنيسيوم الدم كما هو موصوف أعلاه، مع عدم انتظام ضربات القلب، وارتفاع ضغط الدم (علامة لدى البشر ولكن ليست عند بعض حيوانات التجارب مثل القوارض)، والأرق، وتشنجات العضلات (التقلصات الحزمية). ومع ذلك، كما لوحظ، يُعتقد أن أعراض نقص المغنيسيوم الناجم عن النقص الغذائي النقي نادراً ما تظهر.
فيما يلي بعض الأطعمة وكمية المغنيسيوم فيها:
- بذور اليقطين بدون قشر (ربع كوب) = 330 مليغرام.
- بذور الشيا (ربع كوب) = 162 مليغرام.
- دقيق الحنطة السوداء (نصف كوب) = 151 مليغرام.
- الجوز البرازيلي (ربع كوب) = 125 مليغرام.
- نخالة الشوفان النيئة (نصف كوب) = 110 مليغرام.
- مسحوق الكاكاو (ربع كوب) = 107 مليغرام.
- سمك الهلبوت (3 أوقية) = 103 مليغرام.
- اللوز (ربع كوب) = 99 مليغرام.
- الكاجو (ربع كوب) = 89 مليغرام.
- دقيق القمح الكامل (نصف كوب) = 83 مليغرام.
- سبانخ مسلوقة (نصف كوب) = 79 مليغرام.
- السلق السويسري، مسلوق (نصف كوب) = 75 مليغرام.
- شوكولاتة، 70% كاكاو (1 أوقية) = 73 مليغرام.
- توفو، متماسك (نصف كوب) = 73 مليغرام.
- فاصولياء سوداء، مسلوقة (نصف كوب) = 60 مليغرام.
- كينوا، مطبوخة (نصف كوب) = 59 مليغرام.
- زبدة الفول السوداني (2 ملعقة كبيرة) = 50 مليغرام.
- الجوز (ربع كوب) = 46 مليغرام.
- بذور دوّار الشمس، مقشرة (ربع كوب) = 41 مليغرام.
- حمص، مسلوق (نصف كوب) = 39 مليغرام.
- كرنب، مسلوق (نصف كوب) = 37 مليغرام.
- عدس، مسلوق (نصف كوب) = 36 مليغرام.
- دقيق الشوفان، مطبوخ (نصف كوب) = 32 مليغرام.
- صلصة السمك (1 ملعقة كبيرة) = 32 مليغرام.
- حليب خالي من الدسم (1 كوب) = 27 مليغرام.
- قهوة، إسبرسو (1 أوقية) = 24 مليغرام.
- خبز القمح الكامل (شريحة واحدة) = 23 مليغرام.
المدى والتوزيع والتنظيم البيولوجي
في الحيوانات، ثبت أن أنواع الخلايا المختلفة تحافظ على تراكيز مختلفة من المغنيسيوم. يبدو من المرجح أن الأمر نفسه ينطبق على النباتات. يشير هذا إلى أن الأنواع المختلفة من الخلايا تنظم تدفق المغنيسيوم للداخل والخارج بطرق مختلفة بناءً على احتياجاتها الأيضية الفريدة. يجب الحفاظ على التركيزات البينية والجهازية للمغنيسيوم الحر بدقة من خلال العمليات المشتركة للتخزين المؤقت (ربط الأيونات بالبروتينات والجزيئات الأخرى) والتخفيت (نقل الأيونات إلى التخزين أو الفراغات خارج الخلية ).
في النباتات، ومؤخرًا في الحيوانات، عُرِفَ المغنيسيوم باعتباره أيون تبادل إشارات مهم، حيث يعمل على تنشيط العديد من التفاعلات الكيميائية الحيوية والتوسط فيها. ولعل أفضل مثال على ذلك هو تنظيم تثبيت الكربون في البلاستيدات الخضراء في دورة كالفين.
المغنيسيوم مهم جدا في الوظيفة الخلوية. ونقص هذا العنصر الغذائي يسبب مرض للكائن الحي المُتأثر. في الكائنات الحية أحادية الخلية مثل البكتيريا والخميرة، مستويات المغنيسيوم المنخفضة تظهر جلياً في الانخفاض الشديد في معدلات نموها. الحفاظ على المعدلات الصحية من المغنيسيوم في سلالات البكتيريا المُعطّل فيها نقل المغنيسيوم، يكون فقط عن طريق التعرض لتراكيز خارجية عالية جدًا من أيونات المغنيسيوم. في الخميرة، يؤدي نقص المغنيسيوم في الميتوكوندريا أيضًا إلى المرض.
النباتات التي تعاني من نقص المغنيسيوم تُظهر استجابات للإجهاد. إن أولى العلامات التي يمكن ملاحظتها على النبات في كلا الحالتين (نقص المغنيسيوم الشديد أو زيادته المفرطه) هي انخفاض معدل البناء الضوئي. هذا يرجع إلى الوضع المركزي لأيون المغنيسيوم في جزيء الكلوروفيل. الآثار اللاحقة لنقص المغنيسيوم على النباتات هي انخفاض كبير في النمو والقدرة على التكاثر. يمكن للمغنيسيوم أيضاً أن يكون سامًا للنباتات، على الرغم من أن هذا لا يُلاحظ عادةً إلا في ظروف الجفاف.
في الحيوانات، يُلاحظ نقص المغنيسيوم (نقص مغنسيوم الدم) عندما يكون التوافر البيئي للمغنيسيوم منخفضًا. في الحيوانات المجترة، المعرضة بشكل خاص لتوافر المغنيسيوم في أعشاب المراعي، تُعرف الحالة باسم «تكزز العشب». يُحَدّد نقص المغنسيوم في الدم من خلال فقدان التوازن بسبب ضعف العضلات. كما حُدِّد عدد من اضطرابات نقص مغنسيوم الدم الوراثيّة في البشر.
قد يكون التعرض المفرط للمغنيسيوم سامًا للخلايا كلٍّ على حِدَة، على الرغم من صعوبة إظهار هذه التأثيرات تجريبيًا. يحدث فرط مغنسيوم الدم عادةً بسبب فقدان وظائف الكلى. تفرز الحيوانات السليمة المغنيسيوم الزائد في البول والبراز بسرعة. التركيزات المميزة للمغنيسيوم في النماذج الحية هي: في بكتيريا الإشريكية القولونية 30-100 ملي مولار (ثابت ومستقر)، 0.01 - 1 ملي مولار (حر)، في الخميرة البرعمية 50 ملي مولار، في خلية الثديات 10 ملي مولار (ثابت ومستقر)، 0.5 ملي مولار (حر)، وفي بلازما الدم 1 ملي مولار.
الكيمياء الحيوية
المغنيسيوم هو رابع أكثر الأيونات المعدنية وفرة في الخلايا (لكل مول) وهو الأيون الأكثر وفرة بين الأيونات الحرة موجبة الشحنة ثنائية التكافؤ- ونتيجةً لذلك، فهو محبوك بشكل عميق وجوهري في عملية الأيض الخلوي. في الواقع، تظهر الإنزيمات المعتمدة على المغنيسيوم في كل مسار أيضي تقريبًا: كثيراً ما يُلاحَظ الارتباط الخاص المغنيسيوم بالأغشية الحيوية، كما يُستخدَم المغنيسيوم كجزيء تبادل إشارات، كما أن معظم الكيمياء الحيوية الخاصة بالأحماض النووية تتطلب وجود المغنيسيوم، بما في ذلك جميع التفاعلات التي تتطلب إطلاق الطاقة من الأدينوسين ثلاثي الفوسفات. في النيوكليوتيدات، يُثَبَّت الجزء ثلائي الفوسفات من المركب بواسطة الاقتران بالمغنيسيوم في جميع العمليات الإنزيمية.
الكلوروفيل
في كائنات التمثيل الضوئي، يلعب المغنيسيوم دورًا حيويًا إضافيًا يتمثل في كونه الأيون المنسق في جزيء الكلوروفيل. اكتشف هذا الدور ريتشارد فيلشتيتر، الحاصل على جائزة نوبل في الكيمياء عام 1915 لأبحاثه حول الصبغات النباتية، وخاصة الكلوروفيل (تنقية وتركيب الكلوروفيل وارتباطه بالرقم السادس من الكربون).
الأنزيمات
تستخدم كيمياء أيون المغنيسيوم، كما هو مطبق على الإنزيمات، النطاق الكامل لكيمياء التفاعل غير العادية لهذا الأيون لتحقيق مجموعة من الوظائف. يتفاعل المغنيسيوم مع الركائز (المركبات التي تتفاعل مع الموقع النشط في الإنزيم)، الأنزيمات، وأحياناً كلاهما (قد يشكل أيون المغنيسيوم جزءًا من الموقع النشط). بشكل عام، يتفاعل المغنيسيوم مع الركائز من خلال التناسق الكروي الداخلي، أو تثبيت الأنيونات (الأيونات سالبة الشحنة) أو المركبات الوسطية النشيطة، بما في ذلك أيضًا الارتباط بالأدينوسين ثلاثي الفوسفات وتنشيط الهجوم المحب للنواة. عند التفاعل مع الإنزيمات والبروتينات الأخرى، قد يرتبط المغنيسيوم باستخدام التناسق الكروي الداخلي أو الخارجي، إما لتغيير شكل الإنزيم أو المشاركة في كيمياء التفاعل التحفيزي.في كلتا الحالتين، ونظراً لأن المغنيسيوم نادراً ما يكون مجففاً بشكل كامل أثناء الارتباط بالربيطة، فقد يكون جزيء الماء المرتبط بالمغنيسيوم مهمًا أكثر من الأيون نفسه. تُستخدم حموضة لويس للمغنيسيوم (pka 11.4) للسماح بتفاعلات التحلل المائي والتكثيف (أكثرها شيوعًا التحلل المائي لإستر الفوسفات ونقل الفسفور) التي تتطلب قيم حموضة مختلفة جداً عن القيم الفسيولوجية.
دور أساسي في النشاط الحيوي للأدينوسين ثلاثي الفوسفات
يجب أن يرتبط الأدينوسين ثلاثي الفوسفات (ATP)، وهو المصدر الرئيسي للطاقة في الخلايا، بأيون المغنيسيوم حتى يصبح نشطًا حيوياً. ما يسمى ATP غالباً ما يكون في الواقع مغنيسيوم-ثلاثي فوسفات الأدينوسين (Mg-ATP).
الأحماض النووية
للأحماض النووية مجموعة مهمة من التفاعلات مع أيون المغنيسيوم. يعمل ارتباط أيون المغنيسيوم مع الحمض النووي الريبوزي (RNA) والحمض النووي الريبوزي منقوص الأكسجين (DNA) على استقرار التركيب؛ يمكن ملاحظة ذلك في زيادة درجة حرارة الانصهار للحمض النووي الريبوزي منقوص الأكسجين مزدوج الشريطة مع وجود أيون المغنيسيوم. بالإضافة إلى ذلك، تحتوي الريبوسومات على كميات كبيرة من أيونات المغنيسيوم، والتثبيت المقدَّم ضروري لتكوين هذا البروتين الريبي. يربط عدد كبير من الإنزيمات المشاركة في الكيمياء الحيوية للأحماض النووية أيون المغنيسيوم للنشاط، وذلك باستخدام الأيونات في كل من التنشيط والتحفيز. أخيرًا، التحفيز الذاتي للعديد من الريبوزيمات (الإنزيمات التي تحتوي فقط على الحمض النووي الريبوزي) يعتمد على أيونات المغنيسيوم (على سبيل المثال، إنترونات المجموعة الثانية ذاتية الربط في ميتوكندريا الخميرة).
يمكن أن تكون أيونات المغنيسيوم حاسمة في الحفاظ على السلامة الموضعية لمجموعات الفوسفات العنقودية. تظهر هذه المجموعات في أجزاء عديدة ومتميزة من نواة الخلية والسيتوبلازم. على سبيل المثال، ترتبط أيونات المغنيسيوم سداسية الماء في الشق الرئيسي العميق وعند المدخل الخارجي لشكل حرف (A) في الحمض النووي المزدوج.
الغشاء الخلوي والجدار الخلوي
الأغشية الخلوية الحيوية والجدر الخلوية عبارة عن أسطح عديدة الأنيون (أنيون= أيون سالب). وهذا له آثار هامة على نقل الأيونات، خاصة لأنه تبين أن الأغشية المختلفة ترتبط بأيونات مختلفة بشكل تفضيلي. يعمل كل من المغنيسيوم وأيونات الكالسيوم بانتظام على تثبيت الأغشية عن طريق الربط التساهمي لمجموعات الرأس الكربوكسيلية والفوسفورية في الدهون. ومع ذلك، فقد تبين أيضاً أن الغشاء الخلوي للبكتيريا الإشريكية القولونية يرتبط مع الصوديوم والبوتاسيوم والمنغنيز والحديد. يعتمد نقل الأيونات على كل من تدرج تركيز الأيونات والجهد الكهربائي (ΔΨ) عبر الغشاء، والذي سيتأثر بالشحنة على سطح الغشاء. على سبيل المثال، فإن الارتباط المحدد لأيونات المغنيسيوم بغلاف البلاستيدات الخضراء مُتَضَمَّن بفقدان كفاءة التمثيل الضوئي بسبب انسداد امتصاص أيونات البوتاسيوم مما يتسبب بحدوث تحميض ستروما البلاستيدات الخضراء.
البروتينات
يميل أيون المغنيسيوم إلى الارتباط بشكل ضعيف بالبروتينات (ذات ثابت تفكك الحمض<= 105) ويمكن للخلية استغلال ذلك لتشغيل وإيقاف النشاط الأنزيمي عن طريق التغييرات في التركيز المحلي لأيون المغنيسيوم. على الرغم من أن تركيز أيونات المغنيسيوم الحرة في السيتوبلازم يكون في حدود 1 ملي مول/ لتر، فإن محتوى أيونات المغنيسيوم الكلي للخلايا الحيوانية هو 30 ملي مول/ لتر وفي النباتات يقاس محتوى خلايا الأديم الباطن للأوراق بقيم تصل إلى 100 ملي مول/ لتر (1990)، يُخَزَّن الكثير منه في حجرات التخزين. يُخَزَّن التركيز السيتوبلازمي لأيونات المغنيسيوم الحرة عن طريق الارتباط بالمخلّبات (على سبيل المثال، الأدينوسين ثلاثي الفوسفات)، ولكن أيضاً، والذي هو أكثر أهمية، عن طريق تخزين أيون المغنيسيوم في حجرات داخل الخلايا. قد يكون نقل أيونات المغنيسيوم بين الحجرات داخل الخلايا جزءًا رئيسيًا من تنظيم نشاط الإنزيم. يجب أيضًا مراعاة تفاعل أيونات المغنيسيوم مع البروتينات لنقل الأيون عبر الأغشية الحيوية.
المنغنيز
في الأنظمة الحيوية، فقط المنغنيز (Mn2 +) قادر بسهولة على استبدال المغنيسيوم (Mg2 +)، ولكن فقط تحت مجموعة محدودة من الظروف. المنغنيز مشابه جداً للمغنيسيوم من حيث خواصّه الكيميائية، بما في ذلك معقد الغلاف الداخلي والخارجي. يرتبط المنغنيز مع الأدينوسين ثلاثي الفوسفات بشكل فعال ويسمح بالتحلل المائي لجزيء الطاقة بواسطة معظم إنزيمات الأدينوسين ثلاثي الفوسفات. يمكن أيضًا أن يحل المنغنيز محل المغنيسيوم كأيون منشِّط لعدد من الإنزيمات المعتمدة على المغنيسيوم، على الرغم من فقدان بعض نشاط الإنزيم عادةً. في بعض الأحيان، تختلف تفضيلات الإنزيم المعدنية بين الأنواع ذات الصلة الوثيقة: على سبيل المثال، يعتمد إنزيم النسخ العكسي للفيروسات البطيئة مثل فيروس العوز المناعي البشري (HIV) وفيروس العوز المناعي القردي (SIV) وفيروس نقص المناعة لدى القطط (FIV) عادةً على المغنيسيوم، بينما يفضل الإنزيم المماثل للفيروسات القهقرية الأخرى المنغنيز.
الأهمية في ربط الأدوية
ظهرت مقالة تبحث في الأساس البنيوي للتفاعلات بين المضادات الحيوية ذات الصلة إكلينيكيًا والريبوسوم 50S في مجلة نيتشر (Nature) في أكتوبر 2001. أثبتت دراسة البلورات بالأشعة السينية عالية الدقة أن هذه المضادات الحيوية ترتبط فقط بالحمض النووي الريبوزي الريبوسومي 32S لوحدة فرعية ريبوسومية، ولا تتشكل أي تفاعلات مع الجزء بروتيني للوحدة الفرعية. ويؤكد المقال أن النتائج تظهر "أهمية أيونات المغنيسيوم المعروفة في ربط بعض الأدوية.
قياس المغنيسيوم في العينات الحيوية
بواسطة النظائر المشعة
يَسمح استخدام عناصر التتبع المشعة في فحوصات امتصاص الأيونات بحساب Km و Ki و Vmax ويُحدد التغيير الأولي في محتوى الخلايا من الأيونات. يتحلل 28Mg عن طريق انبعاث جسيم بيتا أو غاما عالي الطاقة، والذي يمكن قياسه باستخدام عداد الوميض. ومع ذلك، فإن نصف العمر الإشعاعي لـ 28Mg، وهو أكثر نظائر المغنيسيوم المشعة ثباتًا، هو 21 ساعة فقط. هذا يحد بشدة من التجارب المتعلقة بالنُّوَيدات. أيضًا، منذ عام 1990، لم تُنتج أي منشأة 28Mg بشكل روتيني، ومن المتوقع الآن أن يكون سعر المتر المكعب الواحد حوالي 30 ألف دولار أمريكي. إن الطبيعة الكيميائية للمغنيسيوم تقترب من بعض الكاتيونات (الأيونات الموجبة) الأخرى. ومع ذلك، استُخدِم الكوبالت (Co2+) والمنغنيز (Mn2+) والنيكل (Ni2+) بنجاح لمحاكاة خصائص المغنيسيوم (Mg2+) في بعض التفاعلات الإنزيمية، وقد استُخدمت الأشكال المشعة لهذه العناصر بنجاح في دراسات نقل الكاتيون. تكمن صعوبة استخدام استبدال أيونات المعادن في دراسة وظيفة الإنزيم في أنه من الصعب جداً التأكد من العلاقة بين أنشطة الإنزيم مع الأيون البديل مقارنة مع الأصل.
بواسطة مؤشرات الفلورسنت
عدد من مخلَّبات الكاتيونات ثنائية التكافؤ لها أطياف تألق مختلفة في الحالتين المقيدة وغير المقيدة. مخلَّبات الكالسيوم ثابتة، ولها أُلفة كبيرة للكاتيونات، وتداخل منخفض من أيونات أخرى. مخلَّبات المغنيسيوم تتأخر والصبغة الفلورية الرئيسية للمغنيسيوم (mag-fura 2) في الواقع لها أُلفة أعلى للكالسيوم. هذا يحد من تطبيق هذه الصبغة على أنواع الخلايا التي يكون فيها مستوى الراحة من الكالسيوم أقل من 1 ملي مولار ولا يختلف مع الظروف التجريبية التي يُقاس فيها المغنيسيوم. في الآونة الأخيرة، قام أوتن وآخرون (2001) بوصف العمل في فئة جديدة من المركبات التي قد تكون أكثر فائدة، وأُلفة ارتباطها بالمغنيسيوم أفضل بكثير. يقتصر استخدام الأصباغ الفلورية على قياس أيونات المغنيسيوم الحرة. إذا خَزَّنت الخلية تركيز الأيونات عن طريق استخلابها أو إزالتها إلى حجرات تحت خلوية، فإن معدل الامتصاص المقاس سيعطي فقط قيم صغرى من km و Vmax.
عن طريق الفيزيولوجيا الكهربية
أولاً، يمكن استخدام الأقطاب الدقيقة الخاصة بالأيونات لقياس تركيز الأيونات الحرة الداخلي للخلايا والعضيات. وتتمثل المزايا الرئيسية لهذه الطريقة في أنه يمكن قياس القراءات من الخلايا على مدى فترات زمنية طويلة نسبيًا، وأنها على عكس الأصباغ، يضاف في هذه الطريقة القليل جدًا من سعة تخزين الأيونات الإضافية إلى الخلايا.
ثانيًا، تسمح تقنية مشبك الجهد ثنائي القطب بالقياس المباشر لتدفق الأيونات عبر غشاء الخلية. يُثَبَّت الغشاء على جهد كهربائي ويُقاس تيار الاستجابة. تساهم جميع الأيونات التي تمر عبر الغشاء في التيار المُقاس.
تستخدم تقنية الالتقاط الرقعي أقسامًا معزولة من الغشاء الطبيعي أو الاصطناعي بنفس الطريقة التي يُستخدم بها مشبك الجهد ولكن بدون التأثيرات الثانوية للنظام الخلوي. في ظل الظروف المثالية، يمكن قياس توصيل القنوات الفردية. تعطي هذه المنهجية القياس الأكثر مباشرة لعمل القنوات الأيونية.
عن طريق مطيافية الامتصاص
تحدد مطيافية الامتصاص الذري اللهبي (AAS) محتوى المغنيسيوم الكلي لعينة حيوية. هذه الطريقة مدمرة؛ يجب تقسيم العينات الحيوية في الأحماض المركزة لتجنب انسداد جهاز البخاخات الدقيق.وعلاوة على ذلك، فإن القيد الوحيد هو أن العينات يجب أن تكون بحجم 2 ملي لتر تقريبًا وبنطاق تركيز من 0.1 - 0.4 ميكرو مول/ لتر للحصول على الدقة المثلى. نظرًا لأن هذه التقنية لا يمكنها التمييز أثناء التجربة بين المغنيسيوم الموجود بالفعل في الخلية والمغنيسيوم المُستَهلَك، يمكن فقط تحديد المحتوى الغير مُمتص.
كما تسمح البلازما المقترنة بالحث (ICP) التي يستخدم تعديلات إما مطيافية الكتلة (MS) أو مطيافية الانبعاث الذري (AES) بتحديد المحتوى الأيوني الكلي للعينات الحيوية. هذه التقنيات أكثر حساسية من مطيافية الامتصاص الذري اللهبي وقادرة على قياس كميات الأيونات المتعددة في وقت واحد. ومع ذلك، فهي أيضًا أغلى بكثير.
نقل المغنيسيوم
تمثل الخصائص الكيميائية والكيميائية الحيوية للمغنيسيوم تحديًا كبيرًا للنظام الخلوي عند نقل الأيونات عبر الأغشية الحيوية. ينص مبدأ النقل الأيوني على أن الناقل يتعرف على الأيون ثم يزيل تدريجياً ماء الهدرتة. ويزيل معظم أو كل الماء في المسام الانتقائية قبل إطلاق الأيون على الجانب البعيد من الغشاء. نظراً لخصائص المغنيسيوم، تغير الحجم الكبير من أيون مُهدرت (مميه) إلى أيون مكشوف، وطاقة عالية من الهدرتة (التمييه) ومعدل منخفض جدًا لتبادل الربيطة في التناسق الكروي الداخلي، فإن هذه الخطوات هي على الارجح أكثر صعوبة من الخطوات التي تمر بها معظم الأيونات الأخرى. حتى الآن، أُثبِت أن بروتين ZntA من البراميسيوم هو فقط قناة مغنيسيوم. بدأ الكشف عن آليات نقل المغنيسيوم بواسطة البروتينات المتبقية مع معالجة أول بنية ثلاثية الأبعاد لمركب نقل المغنيسيوم في عام 2004.
يحتوي غلاف التميه الخاص بأيون المغنيسيوم على غلاف داخلي شديد الترابط مكون من ستة جزيئات ماء وقشرة ثانية مرتبطة نسبيًا بإحكام تحتوي على 12-14 جزيء ماء (مَرخَم وآخرون، 2002). وبالتالي، يُفترض أن التعرف على أيون المغنيسيوم يتطلب آلية ما للتفاعل مبدئيًا مع غلاف التميه للمغنيسيوم، متبوعًا بالتعرف/الارتباط المباشر للأيون بالبروتين. نظرًا لقوة المعقد الكروي الداخلي بين المغنيسيوم وأي ربيطة، فإن التفاعلات المتزامنة المتعددة مع بروتين النقل في هذا المستوى قد تؤخر بشكل كبير الأيونات في مسام النقل. ومن ثم، فمن الممكن الاحتفاظ بالكثير من ماء الهدرتة أثناء النقل، مما يسمح بالتناسق الكروي الخارجي الأضعف (ولكن المحدد).
على الرغم من الصعوبة الميكانيكية، يجب نقل المغنيسيوم عبر الأغشية، وقد وُصِفَ عدد كبير من تدفقات المغنيسيوم عبر الأغشية من مجموعة متنوعة من الأنظمة. ومع ذلك، لم تُحدد سوى مجموعة صغيرة من ناقلات المغنيسيوم على المستوى الجزيئي.
إعاقة نشاط قناة أيون الربيطة
عادة ما تكون أيونات المغنيسيوم (Mg2 +) في البيولوجيا الخلوية في جميع معانيها تقريبًا معاكسة لأيونات الكالسيوم، فكلاهما ثنائي التكافؤ، ولكنها تمتلك قدرًا أكبر من الكهرسلبية، وبالتالي تمارس سحبًا أكبر على جزيئات الماء، مما يمنع المرور عبر القناة (على الرغم من أن المغنيسيوم نفسه هو الأصغر). وبالتالي، فإن أيونات المغنيسيوم تحجب قنوات الكالسيوم مثل قنوات ن-مثيل-د-أسبارتات (قنوات NMDA) وقد ثبت أنها تؤثر على قنوات الموصل الفجوي مكونة مشابك كهربائية.
وظيفة المغنيسيوم في النبات
تناولت الأقسام السابقة بالتفصيل الجوانب الكيميائية والكيميائية الحيوية للمغنيسيوم وانتقاله عبر الأغشية الخلوية. سيطبِّق هذا القسم هذه المعرفة على جوانب فسيولوجيا النبات بالكامل، في محاولة لإظهار كيفية تفاعل هذه العمليات مع البيئة الأكبر والأكثر تعقيدًا للكائن الحي متعدد الخلايا.
المتطلبات والتفاعلات الغذائية
يعتبر المغنيسيوم ضروريًا لنمو النبات وهو موجود في النباتات العليا بكميات تصل إلى 80 ميكرومول/غرام من الوزن الجاف. تختلف كميات المغنيسوم في الأجزاء المختلفة من النبات وتعتمد على الحالة التغذوية. في أوقات الوفرة، يمكن تخزين المغنيسيوم الزائد في الخلايا الوعائية (ستيلزر وآخرون، 1990)؛ وفي أوقات الجوع، يُعاد توزيع المغنيسيوم، في العديد من النباتات، من الأوراق الأقدم إلى الأحدث.
تقوم الجذور في النباتات بامتصاص المغنيسيوم. يمكن أن يكون للتفاعلات مع الكاتيونات الأخرى في الغلاف الجذوري تأثير كبير على امتصاص الأيونات.(كورفيتس وكيركبي، 1980) إن بنية الجُدُر الخلوية الجذرية شديدة النفاذية للماء والأيونات، وبالتالي يمكن أن يحدث امتصاص الأيونات في خلايا الجذر في أي مكان بدءًا من شعيرات الجذر إلى الخلايا الموجودة تقريبًا في مركز الجذر (وتُقيَّد فقط في شريط كاسبريان). تحمل الجُدُر والأغشية الخلوية النباتية عددًا كبيرًا من الشحنات السالبة، وتفاعلات الكاتيونات مع هذه الشحنات هي المفتاح لامتصاص الكاتيونات بواسطة الخلايا الجذرية مما يسمح بتأثير التركيز المحلي. يرتبط المغنيسيوم بشكل ضعيف نسبيًا بهذه الشحنات، ويمكن إزاحته بواسطة الكاتيونات الأخرى، مما يعيق الامتصاص ويسبب نقصًا في النبات.
داخل الخلايا النباتية الفردية، تكون متطلبات المغنيسيوم إلى حد كبير مماثلة لجميع أشكال الحياة الخلوية؛ يستخدم المغنيسيوم لتثبيت الأغشية، وهو أساسي لاستخدام الأدينوسين ثلاثي الفوسفات، ويشارك على نطاق واسع في الكيمياء الحيوية للحمض النووي، وهو عامل مساعد للعديد من الإنزيمات (بما في ذلك الريبوسوم). أيضًا، المغنيسيوم هو الأيون المنسق في جزيء الكلوروفيل. إن قيام المغنيسيوم بتقسيم الخلايا إلى حجرات هو الذي يؤدي إلى تعقيد إضافي. سُجِّلت تفاعلات للمغنيسيوم مع أربع حجرات داخل الخلايا النباتية. في البداية، سيدخل المغنيسيوم الخلية في السيتوبلازم (عن طريق نظام غير محدد حتى الآن)، ولكن تركيزات المغنيسيوم الحرة في هذه الحجرة منظمة بإحكام عند مستويات منخفضة نسبيًا (≈2 ملي مول / لتر) وبالتالي فإن أي فائض من المغنيسيوم إما أن يُصَدّر بسرعة أو يُخَزَّن في الحجرة الثانية داخل الخلايا، وهي الفجوة. وُضِّحَت متطلبات المغنيسيوم في الميتوكوندريا في الخميرة ويبدو من المحتمل جدًا أن ينطبق الشيء نفسه على النباتات. تتطلب البلاستيدات الخضراء أن يكون تركيز المغنيسيوم داخلها بكميات كبيرة وأن يكون تركيزه منخفض في السيتوبلازم. بالإضافة إلى ذلك، يبدو من المحتمل أن العضيات دون الخلوية الأخرى (على سبيل المثال، غولجي، الشبكة الإندوبلازمية، إلخ) تتطلب المغنيسيوم أيضًا.
توزيع أيونات المغنيسيوم داخل النبات
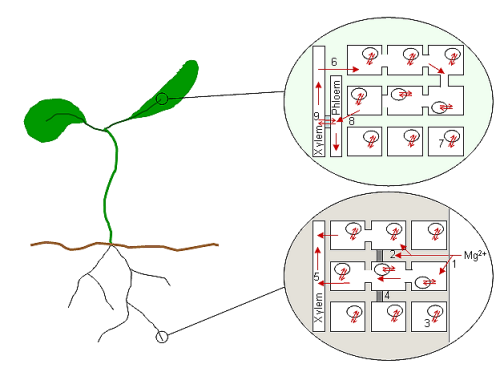
عندما يصبح المغنيسيوم موجوداً بالفراغ السيتوبلازمي للخلايا الجذرية، من المحتمل أن ينتقل مع باقي الكاتيونات بشكل شعاعي في العمود الوعائي (الجزء المركزي من الساق أو الجذر في النباتات الوعائية) والأنسجة الوعائية. من الخلايا المحيطة بالخشب، تُطلَق الأيونات أو تُضَخ في نسيج الخشب وتُحمل للأعلى عبر النبات. في حالة المغنيسيوم، وهو شديد الحركة في كل من نسيج الخشب واللحاء، تُنقل الأيونات إلى أعلى النبات ثم تعود للأسفل في دورة مستمرة من الإمداد. وبالتالي، من المحتمل أن يكون الامتصاص والإفراز من الخلايا الوعائية جزءًا رئيسيًا من توازن المغنيسيوم النباتي الكامل. ويبين الشكل 1 مدى قلة عدد العمليات المتصلة بآلياتها الجزيئية (فقط الامتصاص الفجوي هو المرتبط ببروتين ناقل، AtMHX).
يوضح الشكل البياني رسم تخطيطي للنبات وللعمليات المفترضة لنقل المغنيسيوم في الجذر والورقة حيث يُحمل المغنيسيوم ويُفَرَّغ من الأنسجة الوعائية. يُمتَص المغنيسيوم إلى فراغ الجدار الخلوي في الجذر (1) ويتفاعل مع الشحنات السالبة المرتبطة بالجُدُر والأغشية الخلوية. وقد يُمتص المغنيسيوم إلى الخلايا مباشرة (مسار المُدمج الخلوي/ المسار المتماثل) أو قد ينتقل إلى شريط كاسبريان (4) قبل امتصاصه في الخلايا (ممر خلوي غشائي؛ 2. من المحتمل أن يُخَزَّن تركيز المغنيسيوم في خلايا الجذر عن ظريق التخزين في فجوات الخلايا الجذرية (3). لاحظ أن الخلايا الموجودة في طرف الجذر لا تحتوي على فجوات. عندما يكون في سيتوبلازم خلية جذرية، يتحرك المغنيسيوم نحو مركز الجذر بواسطة الرابطة البلازمية، حيث يُحمل في نسيج الخشب (5) لنقله إلى الأجزاء العلوية من النبات. عندما يصل المغنيسيوم إلى الأوراق، يُفَرَّغ من نسيج الخشب إلى الخلايا (6) ويُخَزَّن مرة أخرى في فجوات (7). غير معروف ما إذا كان دوران المغنيسيوم في اللحاء عبر الخلايا العامة في الورقة (8) أو مباشرة من نسيج الخشب إلى اللحاء عبر خلايا النقل (9). قد يعود المغنيسوم إلى الجذور في عصارة اللحاء.
عند امتصاص أيون المغنيسيوم بواسطة خلية تتطلبه لعمليات التمثيل الغذائي، فمن المفترض عمومًا أن الأيون يبقى في تلك الخلية طالما أن الخلية نشطة. في الخلايا الوعائية، ليس هذا هو الحال دائماً؛ في أوقات الوفرة، يُخَزَّن المغنيسيوم في الفجوة، ولا يشارك في عمليات التمثيل الغذائي اليومية للخلية (ستيلزر وآخرون، 1990)، ويُطلق عند الحاجة، ولكن بالنسبة لمعظم الخلايا، فإن الموت بسبب الشيخوخة أو الإصابة هو الذي يطلق المغنيسيوم والعديد من المكونات الأيونية الأخرى، ويعيد تدويرها إلى أجزاء صحية من النبات. الإضافة إلى ذلك، عندما يكون المغنيسيوم في البيئة محدودًا، تكون بعض الأنواع قادرة على تحريكه من الأنسجة القديمة. تتضمن هذه العمليات إطلاق المغنيسيوم من حالته المقيدة والمخزنة ونقله مرة أخرى إلى الأنسجة الوعائية، حيث يمكن توزيعه على باقي أجزاء النبات. في أوقات النمو والتطور، يعاد توزيع المغنيسيوم داخل النبات مع تغير علاقات المصدر والمنفذ.
يُحافَظ على توازن المغنيسيوم داخل الخلايا النباتية المفردة من خلال العمليات التي تحدث في غشاء البلازما وفي غشاء الفجوة (انظر الشكل 2). القوة الدافعة الرئيسية لانتقال الأيونات في الخلايا النباتية هي ΔpH. أنزيم الأدينوسين ثلاثي الفوسفات المعتمد على البروتون يضخ أيونات الهيدروجين عكس تدرج تركيزها للحفاظ على تمايز درجة الحموضة التي يمكن استخدامها لنقل الأيونات والجزيئات الأخرى. تُضخ أيونات الهيدروجين من السيتوبلازم إلى الفراغ خارج الخلية أو في الفجوة. يدخل المغنيسيوم إلى الخلايا من خلال أحد المسارين، عبر قنوات باستخدام ΔΨ (سالب من الداخل) عبر هذا الغشاء أو مع أيونات الهيدروجين بنفس الاتجاه في نفس القناة. لنقل أيون المغنيسيوم في الفجوة يتطلب ناقل +Mg2+/ H منادل عكسي (ينقل المغنيسيوم والهيدروجين بنفس الناقل في اتجاه متعاكس) (مثل AtMHX). يعتمد «أنزيم الأدينوسين ثلاثي الفوسفات المعتمد على البروتون» على المغنيسيوم (المرتبط على الأدينوسين ثلاثي الفوسفات) للنشاط، بحيث يكون المغنيسيوم مطلوبًا للحفاظ على توازنه الخاص.
يُعرَض مخطط لخلية نباتية بما في ذلك الحجرات الرئيسية الأربعة المعروف حاليًا على أنها تتفاعل مع المغنيسيوم. يحافظ أنزيم الأدينوسين ثلاثي الفوسفات المعتمد على البروتون على فرق ثابت في الحموضة (ΔpH) عبر غشاء البلازما وغشاء الفجوة. يُنقل المغنيسيوم إلى الفجوة باستخدام طاقة ΔpH (في رشاد أذن الفأر بواسطة AtMHX). قد يستخدم نقل المغنيسيوم إلى الخلايا إما سالب ΔΨ أو ΔpH. ربما يستخدم نقل المغنيسيوم إلى الميتوكوندريا ΔΨ، كما هو الحال في الميتوكوندريا في الخميرة، ومن المحتمل أن تأخذ البلاستيدات الخضراء المغنيسيوم بواسطة نظام مماثل. الآلية والأساس الجزيئي لإطلاق المغنيسيوم من الفجوات ومن الخلية غير معروفين.وبالمثل، فإن تغيرات تركيز المغنيسيوم المنظمة للضوء في البلاستيدات الخضراء ليست مفهومة تمامًا، ولكنها تتطلب نقل أيونات الهيدروجين عبر غشاء الثايلاكويد.
المغنيسيوم والبلاستيدات الخضراء والبناء الضوئي
المغنيسيوم هو الأيون الفلزي المنسق في جزيء الكلوروفيل، وفي النباتات التي يكون فيها التزويد بالأيون مرتفعًا، يرتبط 6٪ من إجمالي المغنيسيوم بالكلوروفيل. تُثَبَّت طبقات الثايلاكويد المتراصة بواسطة المغنيسيوم وهو مهم لكفاءة التمثيل الضوئي، مما يسمح بحدوث التحول الطوري.
قد يُمتَص المغنيسيوم في البلاستيدات الخضراء إلى أقصى حد خلال التطور الناجم عن الضوء من بلاستيدات أولية إلى بلاستيدات خضراء أو من بلاستيدات شاحبة إلى بلاستيدات خضراء. في هذه الأوقات، يتطلب تخليق الكلوروفيل والتكوين الحيوي لأغشية الثايلاكويد المتراصة تمامًا الكاتيون ثنائي التكافؤ.
ما إذا كان المغنيسيوم قادرًا على الانتقال إلى داخل وخارج البلاستيدات الخضراء بعد هذه المرحلة التنموية الأولية كان موضوع العديد من التقارير المتضاربة. وجد ديشايز وآخرون (1948) أن المغنيسيوم تحرك داخل وخارج البلاستيدات الخضراء المعزولة من نباتات البازلاء الصغيرة، لكن جوبتا وبيركوفيتز (1989) لم يتمكنوا من إعادة النتيجة مجدداً باستخدام البلاستيدات الخضراء القديمة في السبانخ. ذكر ديشايز وآخرون في ورقتهم البحثية أن البلاستيدات الخضراء القديمة في البازلاء أظهرت تغيرات أقل أهمية في محتوى المغنيسيوم من تلك المستخدمة لتشكيل استنتاجاتهم. قد تفسر الحصة النسبية للبلاستيدات الخضراء غير الناضجة الموجودة في المستحضرات هذه الملاحظات.
تتغير الحالة الأيضية للبلاستيدات الخضراء بشكل كبير بين الليل والنهار. خلال النهار، تعمل البلاستيدات الخضراء بنشاط على جمع طاقة الضوء وتحويلها إلى طاقة كيميائية. يأتي تنشيط المسارات الأيضية ذات الصلة من التغيرات في الطبيعة الكيميائية للستروما عند إضافة الضوء. يُضَخ أيون الهيدروجين من الستروما (في كل من السيتوبلازم والتجويف) مما يؤدي إلى جعل درجة الحموضة قلوية. يُحَرَّر المغنيسيوم (جنبًا إلى جنب مع البوتاسيوم) من التجويف إلى الستروما، في عملية تحييد إلكتروني لموازنة تدفق أيونات الهيدروجين. أخيرًا، تُقلَّل مجموعات الثيول الموجودة على الإنزيمات من خلال تغيير حالة الأكسدة والاختزال في الستروما. من الأمثلة على الإنزيمات التي تُنشّط استجابة لهذه التغييرات فروكتوز ثنائي الفوسفاتاز، سيدوهبتولوز ثنائي الفوسفاتاز وريبولوز-1,5-كربوكسيلاز مضاعف فوسفات. خلال فترة الظلام، إذا كانت هذه الإنزيمات نشطة، فقد يحدث إهدار في تدوير النواتج والركائز.
يمكن تحديد فئتين رئيسيتين من الإنزيمات التي تتفاعل مع المغنيسيوم في الستروما أثناء طور الضوء. أولاً، غالبًا ما تتفاعل الإنزيمات في مسار التحلل الغلايكولي مع ذرتين من المغنيسيوم. تعتبر الذرة الأولى بمثابة مُعدِّل تفارغي لنشاط الإنزيمات، بينما تشكل الذرة الثانية جزءًا من الموقع النشط وتشارك مباشرة في التفاعل التحفيزي. تشمل الفئة الثانية من الإنزيمات تلك التي يتجمع فيها المغنيسيوم مع نيوكليوتيدات ثنائي وثلاثي الفوسفات (ADP و ATP)، ويتضمن التغير الكيميائي نقل الفوسفوريل. قد يخدم المغنيسيوم أيضًا في دور الصيانة الهيكلية في هذه الإنزيمات (على سبيل المثال، إينولاز).
إجهاد المغنيسيوم
المقالة الرئيسية: نقص مغنيسيوم الدم
يمكن ملاحظة استجابات إجهاد النبات في النباتات التي تعاني من نقص أو زيادة في إمداد المغنيسيوم. أولى علامات إجهاد المغنيسيوم التي يمكن ملاحظتها على النباتات لكل من النقص والسمية هي انخفاض معدل التمثيل الضوئي. ويفترض ذلك بسبب العلاقات القوية بين المغنيسيوم والبلاستيدات الخضراء/ الكلوروفيل. في أشجار الصنوبر، حتى قبل الظهور المرئي للبقع الصفراء والنخرية، تنخفض كفاءة الإبر (أوراق الصنوبر) في التمثيل الضوئي بشكل ملحوظ. في عوز المغنيسيوم، تشمل التأثيرات الثانوية المسجلة عدم حركة الكربوهيدرات، وفقدان نسخ الحمض النووي الريبوزي (RNA) وفقدان بناء البروتين. ومع ذلك، نظرًا لحركة المغنيسيوم داخل النبات، قد يكون النمط الظاهري للنقص موجودًا فقط في الأجزاء القديمة من النبات. على سبيل المثال، عند نقص المغننيسيوم في الأجسام الصنوبرية شعاعية الشكل، فإن إحدى أولى العلامات الملحوظة هي شحوب الأوراق الإبرية على الفروع السفلية للشجرة. وذلك استرداد المغنيسيوم من هذه الأنسجة ونقله إلى إبر (خضراء) أعلى في الشجرة.
يمكن أن يحدث نقص المغنيسيوم بسبب نقص الأيون في الوسط (التربة)، ولكن بشكل أكثر شيوعًا يأتي من تثبيط امتصاصه. يرتبط المغنيسيوم بشكل ضعيف جدًا بالمجموعات سالبة الشحنة في جُدُر الخلايا الجذرية. حيث يمكن للفائض من الكاتيونات الأخرى مثل البوتاسيوم، الأمونيوم، الكالسيوم والمنغنيز أن يعيق الامتصاص. (كورفيتس وكيركبي، 1980؛) في التربة الحمضية، يعتبر الألمنيوم (Al3+) بشكل خاص مثبطًا قويًا لامتصاص المغنيسيوم. يكون التثبيط بواسطة الألمنيوم والمنغنيز أكثر شدة مما يمكن تفسيره بالإزاحة البسيطة، ومن ثم فمن الممكن أن ترتبط هذه الأيونات بنظام امتصاص المغنيسيوم مباشرة. في البكتيريا والخميرة، لوحِظَ بالفعل هذا الارتباط بواسطة المنغنيز. تتطور استجابات الإجهاد في النبات مع توقف العمليات الخلوية بسبب نقص المغنيسيوم (مثل الحفاظ على ΔpH عبر الغشاء الخلوي وأغشية الفجوة). سُجِّلت نسبة المغنيسيوم المرتبطة بالكلوروفيل في النباتات التي تعاني من نقص المغنيسيوم في ظروف الإضاءة المنخفضة فكانت 50٪. من المفترض أن هذا الخلل له آثار ضارة على العمليات الخلوية الأخرى.
يعتبر إجهاد سمية المغنيسيوم أكثر صعوبة في التطور. عندما يكون المغنيسوم وفيرًا، فإن النباتات بشكل عام تمتص الأيونات وتخزنها (ستيلزر وآخرون، 1990). ومع ذلك، إذا أعقب ذلك الجفاف، يمكن أن تزداد التركيزات الأيونية داخل الخلية بشكل كبير. تعمل تركيزات المغنيسيوم السيتوبلازمية العالية على إغلاق قناة البوتاسيوم في الغشاء الداخلي للبلاستيدات الخضراء، مما يمنع بدوره إزالة أيونات (H+) من ستروما البلاستيدات الخضراء. يؤدي هذا إلى تحمض الستروما مما يثبط نشاط الإنزيمات الرئيسية في تثبيت الكربون، وهذا كله يؤدي إلى إنتاج الجذور الحرة للأكسجين في البلاستيدات الخضراء التي تسبب أضرارًا تأكسدية.
انظر أيضًا
ملاحظات
مراجع
-
Romani، Andrea M.P. (2013). "Chapter 4 Magnesium Homeostasis in Mammalian Cells". في Banci، Lucia (المحرر). Metallomics and the Cell. Metal Ions in Life Sciences. Springer. ج. 12. doi:10.1007/978-94-007-5561-l_4 (غير نشط 19 يناير 2021). ISBN 978-94-007-5560-4.
{{استشهاد بكتاب}}: صيانة CS1: وصلة دوي غير نشطة منذ 2021 (link) electronic-book (ردمك 978-94-007-5561-1) ISSN 1559-0836 electronic-ISSN 1868-0402 - Findling، R. L.؛ Maxwell، K؛ Scotese-Wojtila، L؛ Huang، J؛ Yamashita، T؛ Wiznitzer، M (1997). "High-dose pyridoxine and magnesium administration in children with autistic disorder: an absence of salutary effects in a double-blind, placebo-controlled study". J Autism Dev Disord. ج. 27 ع. 4: 467–478. doi:10.1023/A:1025861522935. PMID 9261669. S2CID 39143708.
- Green، V.؛ Pituch، K.؛ Itchon، J.؛ Choi، A.؛ O'Reilly، M.؛ Sigafoos، J. (2006). "Internet Survey of Treatments Used by Parents of Children with Autism". Research in Developmental Disabilities. ج. 27 ع. 1: 70–84. doi:10.1016/j.ridd.2004.12.002. PMID 15919178.
- Lelord، G.؛ Muh، JP؛ Barthelemy، C؛ Martineau، J؛ Garreau، B؛ Callaway، E (1981). "Effects of pyridoxine and magnesium on autistic symptoms--initial observations". J Autism Dev Disord. ج. 11 ع. 2: 219–230. doi:10.1007/BF01531686. PMID 6765503. S2CID 7898722.
- Martineau، J.؛ وآخرون (1985). "Vitamin B6, magnesium, and combined B6-Mg: therapeutic effects in childhood autism." Biol". Psychiatry. ج. 20 ع. 5: 467–478. doi:10.1016/0006-3223(85)90019-8. PMID 3886023. S2CID 631153.
- Tolbert، L.؛ Haigler، T؛ Waits، MM؛ Dennis، T (1993). "Brief report: lack of response in an autistic population to a low dose clinical trial of pyridoxine plus magnesium". J Autism Dev Disord. ج. 23 ع. 1: 193–199. doi:10.1007/BF01066428. PMID 8463199. S2CID 21450498.
- Mousain-Bosc M، Roche M، Polge A، Pradal-Prat D، Rapin J، Bali JP (مارس 2006). "Improvement of neurobehavioral disorders in children supplemented with magnesium-vitamin B6. I. Attention deficit hyperactivity disorders". Magnes. Res. ج. 19 ع. 1: 46–52. PMID 16846100.
- Mousain-Bosc M، Roche M، Polge A، Pradal-Prat D، Rapin J، Bali JP (مارس 2006). "Improvement of neurobehavioral disorders in children supplemented with magnesium-vitamin B6. II. Pervasive developmental disorder-autism". Magnes. Res. ج. 19 ع. 1: 53–62. PMID 16846101.