ميتوكندريون

المُتَقَدِّرَة أو الميتوكندريون أو المصورات الحيوية أو الحُبَيبَات الخَيطِيَّة هي عضية خلوية مزدوجة الغشاء تتواجد لدى معظم الكائنات حقيقية النوى. يمكن أن لا تملك بعض الخلايا في بعض الكائنات متعددة الخلايا متقدرات (مثل خلايا الدم الحمراء الناضجة الخاصة بالثدييات). العديد من الكائنات وحيدة الخلية مثل البويغيات، ذوات الجسيم القاعدي والمتضاعفات خفّضت أو حوّلت المتقدرات الخاصة بها إلى عضيات أخرى. لغاية اليوم، لا يُعرف سوى جنس حقيقات نوى وحيد فقد متقدراته كليا وهو مونوسيركومونيودات. المصطلح الأجنبي ميتوكندريون من أصل إغريقي "μίτος" ميتوس، بمعنى خيط و"χονδρίον" كوندريون، بمعنى حبيبة أو حبيبي الشكل. تولِّد المتقدرات معظم احتياجات الخلية من الأدينوسين ثلاثي الفوسفات (ATP) المستخدم كمصدر للطاقة الكيميائية في التفاعلات الخلوية. ولهذا يطلق على المتقدرة لقب «محطة توليد الطاقة» الخلوية.
تترواح مساحة المتقدرة عادة بين 0.75 و3 ميكرومتر مربع لكنها تختلف بشكل معتبر في الحجم والبنية، وهي غير مرئية إلا إذا تم صبغها. فضلا عن تزويدها الخلية بالطاقة، للمتقدرة دور في وظائف أخرى مثل التأشير والتمايز الخلويين، وفي موت الخلية، وكذلك في الحفاظ على التحكم في دورة الخلية وتكاثرها. يُنسَّق النشوء الحيوي للمتقدرة بدوره مع هذه العمليات الخلوية. للمتقدرات دور في العديد من الأمراض البشرية منها: أمراض المتقدرة، اختلال وظيفة القلب،فشل القلب،والتوحد.
يمكن أن يختلف عدد المتقدرات في الخلية بشكل كبير حسب النسيج ونوع الخلية. على سبيل المثال لا تملك خلايا الدم الحمراء أية متقدرات، في حين يمكن أن تملك خلايا الكبد أزيد من 2000 متقدرة. تتكون هذه العضية من أحياز تقوم بوظائف مخصصة، هذه الأحياز أو المناطق هي: الغشاء الخارجي، الحيز بين الغشائي، الغشاء الداخلي والنتوءات العرفية والمطرس.
رغم أن معظم دنا الخلية يتواجد في نواة الخلية، تملك المتقدرة جينومها الخاص بها الذي يُظهِر تشابها كبيرا مع الجينومات البكتيرية. بروتينات المتقدرة (البروتينات التي تُنسخ من دنا المتقدرة) تختلف حسب النسيج والنوع. لدى البشر، تم تحديد 615 نوعا مميزا من البروتينات من المتقدرات القلبية، أما لدى الجرذان فقط تم الإبلاغ عن 940 نوع من البروتين. يُعتقد أن البروتيوم الخاص بالمتقدرة يُنظم بشكل ديناميكي.
البنية

تتكون المتقدرة من غشائين داخلي وخارجي مكونين من ليبيدات ثنائية الطبقة وبروتينات. للغشائين خصائص مختلفة. بسبب هذا التنظيم ثنائي الغشاء، توجد خمس مناطق مميزة في المتقدرة هي:
- غشاء المتقدرة الخارجي.
- الفضاء بين الغشائي (الفضاء بين الغشائين الخارجي والداخلي).
- غشاء المتقدرة الداخلي.
- النؤات العرفية (الأعراف)
- المطرس (الفضاء داخل الغشاء الداخلي)
تسمى المتقدرة التي لا تحتوي على غشاء خارجي ميتوبلاست.
الغشاء الخارجي
غشاء المتقدرة الخارجي الذي يحيط ويغلف كامل العضية سمكه من 60 إلى 70 أنغستروم. لهذا الغشاء معدل بروتين مقابل ليبيد فوسفوري مساوٍ لمعدل الغشاء الخلوي (حوالي 1:1 وزنا، أي 50% من وزنه بروتين و50% ليبيد) ويحتوي على أعداد كبيرة من البروتينات الغشائية المدمجة تسمى بورينات. أحد أهم البروتينات الناقلة به هو مشكِّل المسام قناة الأنيون المعتمدة على الفولتية (VDAC). قناة الأنيون المعتمدة على الفولتية هي الناقل الرئيسي للنوكليوتيدات، الأيونات، والمستقلبات بين العصارة الخلوية والفضاء بين الغشائي. يتكون من براميل بيتا تمتد خلال كامل سمك الغشاء الخارجي، كما هو الحال في غشاء البكتيريا سلبية الغرام. يمكن أن تُدخِل المتقدرة بروتينات أكبر إذا ارتبط تسلسل تأشيرٍ في نهاياتها الأمينية ببروتين أكبر متعدد الوحدات الفرعية يسمى ترانسلوكاز الغشاء الخارجي، والذي يقوم بعد ذلك بتحريكهم بنشاط عبر الغشاء. يتم توريد الطلائع البروتينية الخاصة بالمتقدرة عبر مركبات نقل خاصة.
يحتوي الغشاء الخارجي كذلك على إنزيمات لها أدوار متنوعة مثل تمديد الأحماض الدهنية، أكسدة الإبنيفرين، وتفكيك التريبتوفان. من هذه: الإنزيمات أكسيداز أحادي الأمين، مختزلة-c NADH-سيتوكروم غير الحساسة للروتينون هيدروكسيلاز الكينورينين وليغاز كو-أ—حمض دهني . يسمح تمزيق الغشاء الخارجي للبروتينات في الفراغ بين الغشائي بالتسرب إلى العصارة الخلوية، وهذا يؤدي إلى نوع معين من موت الخلية. يمكن أن يرتبط الغشاء الخارجي للمتقدرة بالشبكة الإندوبلازمية في بنية تسمى غشاء الشبكة الإندوبلازمية المرتبط بالمتقدرة (MAM). هذا الارتباط مهم بالنسبة لتأشير الكالسيوم بين الشبكة الإندوبلازمية والمتقدرة وله دور في نقل اللبيدات بينها. توجد خارج الغشاء الخارجي جسيمات صغيرة (قطرها 60 أنغستروم) تسمى الوحدات الفرعية الخاصة ببارسون.
الفضاء بين الغشائي
فضاء المتقدرة بين الغشائي هو فضاء بين الغشاء الخارجي والداخلي. ويعرف كذلك بفضاء المتقدرة المحيطي. تكون تركيزات الجزيئات الصغيرة فيه مثل الأيونات والسكريات القادرة على النفاذ بحرية عبر الغشاء الخارجي مساوية لتركيزاتها في العصارة الخلوية. مع ذلك، يجب أن يكون للبروتينات الكبيرة تسلسلات تأشير محددة لتتمكن من الانتقال عبر الغشاء الخارجي، لذلك فإن أنواع البروتينات وكمياتها في هذا الفضاء تختلف عما هو موجود في العصارة الخلوية. أحد البروتينات التي تنتقل إلى الفضاء بين الغشائي هو سيتوكروم سي.
الغشاء الداخلي
يحتوي غشاء المتقدرة الداخلي على بروتينات تقوم بخمسة أنواع من الوظائف:
- البروتينات التي تقوم بتفاعلات الأخسدة الخاصة بالفسفرة التأكسدية.
- مخلقة الـATP التي تقوم بتخليق الـATP في المطرس.
- بروتينات نقل خاصة تنظم عبور المستقلبات داخل وخارج مطرس المتقدرة.
- ماكينة التوريد البروتينية.
- بروتين اندماج وانشطار المتقدرة.
يحتوي الغشاء على ما يزيد عن 151 عديد ببتيد مختلف ويملك نسبة بروتين إلى ليبيد فوسفوري عالية (أكثر من 1:3 وزنا، وهو ما يقارب بروتينا واحدا لكل 15 ليبيد فوسفوري). الغشاء الداخلي هو مقر لخُمُسِ مجموع البروتينات المتواجدة في المتقدرات. فضلا عن ذلك، هذا الغشاء غني باللبيد الفوسفوري غير المعتاد كارديوليبين. اكتُشف هذا الليبيد الفوسفوري أول مرة سنة في قلوب الأبقار سنة 1942، ويكون عادة سمة مميزة لأغشية البلازما الخاصة بالمتقدرات والبكتيريا. يحتوي الكارديوليبين على أربع أحماض دهنية بدل اثنين وذلك ربما يساعد في جعل الغشاء الداخلي غير قابل للنفاذية (كتيم). عكس الغشاء الخارجي، لا يملك الغشاء الداخلي بورينات وهو عديم النفاذية بصفة عالية لجميع الجزيئات. جميع الأيونات والجزيئات تقريبا تتطلب ناقلات غشائية خاصة لتدخل أو تخرج من المطرس. تُنقل البروتينات إلى المطرس عبر مركب ترانسلوكاز الغشاء الداخلي (TIM) أو عبر OXA1L. فضلا عن ذلك، يوجد جهد غشائي على طول الغشاء الداخلي مُتشكِّل بواسطة فعل إنزيمات سلسلة نقل الإلكترون.
النتؤات العرفية
الغشاء الداخلي للمتقدرة مجزأ إلى عدة أحياز تعرف بالأعراف والتي تمدِّد مساحة السطح الخارجي للغشاء الداخلي، محسنة قدرته على إنتاج الـATP. في متقدرةِ كبدٍ قياسية، مساحة الغشاء الداخلي حوالي خمس أضعاف مساحة الغشاء الخارجي. هذا المعدل متغير، والحاجة إلى الـATP من المتقدرة تختلف حسب نوع الخلية، كمثال: تحتوي الخلايا العضلية على نتوءات عرفية أكثر من غيرها. هذه الطيات مرصعة بأجسام صغيرة دائرية تعرف باسم F1 أو جسيمات الأكسجين. هذه الطيات ليست طيات عشوائية بسيطة وإنما انغمادات للغشاء الداخلي، والتي يمكن أن تؤثر في مجمل وظيفة التناضح الكيميائي.
اقترحت دراسة نمذجة رياضياتية حديثة أن الخصائص البصرية للنتوءات العرفية في المتقدرات الخيطية قد تؤثر على توليد وانتشار الضوء داخل النسيج.
المطرس
المطرس أو المصفوفة هو الحيز الذي يحيط به الغشاء الداخلي، ويحتوي على حوالي ثلثي مجموع البروتينات في المتقدرة. المطرس مهم في إنتاج الـATP بمساعدة مخلقة الأتِباز المتواجدة في الغشاء الداخلي. تحتوي المصفوفة على خليط عالي التركيز من مئات الإنزيمات، خاصة ريبوسومات المتقدرة، الرنا الريبوسومي، وعدة نسخ من جينوم دنا المتقدرة. من الوظائف الرئيسية لهذه الإنزيمات: أكسدة أحماض البيروفيك والأحماض الدهنية، ودورة حمض الستريك. جزيئات الدنا محزمة في نووانيات بواسطة بروتينات أحدها هو TFAM.
للمتقدرات مادتها الوراثية الخاصة بها، ولها ماكينة لتخليق جزيئات رنا وبروتينات خاصة بها. أظهر تسلسل دنا متقدرة منشور أنه يحوي 16569 زوج قاعدي تشفِّر 37 جينا: 22 رنا ناقل، 2 رنا ريبوسومي و13 ببتيدا. البيبتيدات المتقدرية الـ13 لدى البشر يتم إدماجها في الغشاء الداخلي للمتقدرة، إلى جانب بروتينات مشفَّرة بواسطة جينات تتواجد في نواة الخلية المضيفة.
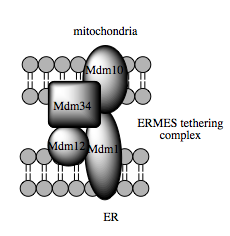
غشاء الشبكة الإندوبلازمية المرتبط بالمتقدرة
غشاء الشبكة الإندوبلازمية المرتبط بالمتقدرات (MAM) هو عنصر بنيوي آخر تتزايد المعرفة حول دوره الحاسم في الفيسيولوجية والاستتباب الخلويين. اعتُبر سابقا أنه عقبة تقنية في تقنيات التجزيء الخلوي، أعيد تعريف شوائب حويصلات الشبكة الإندوبلازمية التي كانت تظهر بثبات في عمليات تجزيء المتقدرات على أنها امتدادات مصدرها غشاء MAM وهو الوسيط بين المتقدرات والشبكة الإندوبلازمية. الاقتران الفيزيائي بين هاتين العضيتين تمت ملاحظته سابقا بواسطة صور مجهرية إلكترونية وتم سبرها حديثا بواسطة المجهرية الفلورية. تُقدِّر مثل تلك الدراسات أن عند هذه الأغشية - التي يمكن أن تشكل حتى 20% من الغشاء الخارجي للمتقدرة - المسافة بين الشبكة الإندوبلازمية والمتقدرة لا تتجاوز 10-25 نانومتر وهما محكمان معا بواسطة مركبات بروتينية رابطة.
أظهرت أغشية الشبكة المرتبطة بالمتقدرة المنقاة من التجزيئات الخلوية أنها غنية بالإنزيمات التي لها دور في تبادل الليبيدات الفوسفورية بالإضافة إلى قنوات مرتبطة بتأشير الكالسيوم Ca2+. هذه التلميحات إلى دور مهم لهذه الأغشية في تنظيم المخزونات الخلوية من اللبيدات وتوصيل الإشارة ثبتت صحتها، مع آثار مترتبة معتبرة على الظاهرة الخلوية المرتبطة بالمتقدرة. هذه الأغشية لم توفر رُؤًى للأسس الميكانيكية لمثل هذه العمليات الفيسيولوجية مثل الاستماتة الذاتية وانتشار تأشير الكالسيوم فحسب، بل تدعم نظرة أوسع بخصوص دور المتقدرات. رغم أن المتقدرات تُرى «كمحطات توليد طاقة» ساكنة ومعزولة استُغلت من أجل الأيض الخلوي بواسطة حادثة نشوء تعايشي قديمة، يؤكد تطور غشاء MAM مدى دور المتقدرات في مجمل الفيسيولوجية الخلوية، الذي يربطه اقتران فيزيائي ووظيفي حميم مع النظام الغشائي الداخلي.
انتقال الليبيد الفسفوري
غشاء الشبكة المرتبط بالمتقدرات غني بالإنزيمات التي تقوم بتخليق الليبيدات مثل مخلِقة فوسفاتيديل سيرين على الجانب الخاص بالشبكة الإندوبلازمية ونازعة كربوكسيل فوسفاتيديل سيرين على الجانب الخاص بالمتقدرة. لأن المتقدرات عضيات ديناميكية تخضع للانقسام والاندماج فهي تحتاج لتزويد مستمر ومنظَّم جيدا بالليبيدات الفوسفورية لسلامة الأغشية وكمالها. المتقدرات ليست الوجهة التي ينتهي فيها تخليق الليبيدات فحسب، بل تلعب دورا كعضية وسيطة في نقل وسائط ونواتج مسارات: التخليق الحيوي لليبيدات، أيض السيراميد والكوليستيرول، وأيض الليبيدات السفنغولية السكرية.
هذه القدرة على النقل تعتمد على غشاء MAM، الذي اتضح أنه يُسهل نقل الليبيدات بين العضيات. على عكس آلية الحويصلات القياسية لنقل الليبيدات، تشير دلائلٌ إلى أن المقربة الفيزيائية بين غشائي الشبكة الإندوبلازمية والمتقدرة في غشاء MAM تسمح بانتقال الليبيدات بين الغشائين المزدوجين المتقابلين. رغم أن آلية النقل هذه تبدو غير اعتيادية وغير مفضلة طاقويا إلا أنها لا تحتاج ATP. في الخميرة، تم إظهار أنها تعتمد على بنية عديد بروتين رابطة تسمى بنية التقاء الشبكة الإندوبلازمية والمتقدرة (ERMES). مع ذلك، ما زال غير واضح إن كانت هذه البنية تتوسط بشكل مباشر نقل الليبيدات أو أنها مطلوبة لإبقاء الغشائين على مقربة كافية لتخفيض كمية طاقة نقل الليبيدات.
فضلا عن دورها في النقل داخل الخلوي يُعتقد كذلك أن أغشية MAM جزء من مسار إفرازي. بشكل خاص، يبدو أن هذه الأغشية هي وجهة وسطية بين الشبكة الإندوبلازمية وجهاز غولجي في المسار الذي يقود إلى تركيب وإفراز البروتين اللبيدي منخفض الكثافة (VLDL)، ولذلك غشاء الشبكة الإندوبلازمية المرتبط بالمتقدرة يعمل كمركز أساسي وحاسم في أيض ونقل الليبيدات.
تأشير الكالسيوم
عُرف دور الشبكة الإندوبلازمية الحاسم في تأشير الكالسيوم قبل أن يُعرف دور المتقدرة فيه ويلاقي قبولا واسعا، ويعود ذلك جزئيا إلى ألفة قنوات الكالسيوم المنخفضة لـ Ca2+ التي تتواجد على الغشاء الخارجي، وهذا يناقض الاستجابات المتقدرة المزعومة لتغيير تدفق الكالسيوم داخل الخلوي. تواجدُ أغشية MAM حلَّ هذا التناقض الظاهري، فالتقارب الفيزيائي بين هاتين العضيتين ينتج عنه نطاقات ميكروية خاصة بالـCa2+ في نقاط الاتصال تسهل النقل الفعال لأيونات الكالسيوم من الشبكة الإندوبلازمية إلى المتقدرة. يحدث النقل استجابة لما يُعرف «بنفائش الكالسيوم» المولَّدة بواسطة تكدسات تلقائية لقنوات IP3R وتنشيطها، وهي قنوات كالسيوم قياسية في الشبكة الإندوبلازمية.
يُحدَّد مصير هذه النفائش - إن كانت ستبقى محصورة في مناطق معزولة أو تُدمج في موجات كالسيوم لتنتشر في أنحاء الخلية - بنسبة كبيرة بواسطة حركيات غشاء MAM. رغم أن استرداد أيونات الكالسيوم بواسطة الشبكة الإندوبلازمية (المصاحب لتحريره) يُعدِّل شدة النفائش، مما يعزل المتقدرة بدرجة معينة من التعرض العالي لأيونات الكالسيوم، غالبا ما يعمل غشاء MAM كجدار حماية يقوم أساسا بدرء نفائش الكالسيوم بالتصرف كبالوعة يمكن لأيونات الكالسيوم الحرة في العصارة الخلوية أن تدخل فيها.
يحدث تنفيق الكالسيوم بسبب الألفة المنخفضة لمستقبل VDAC1 للكالسيوم، والذي أُظهِر حديثا أنه مربوط فيزيائيا بتكدسات IP3R على غشاء الشبكة الإندوبلازمية وأنه متواجد بكثرة في غشاء MAM. قدرة المتقدرات في العمل كبالوعات للكالسيوم هي نتيجة للمدروج الكهروكيميائي المتولد أثناء الفسفرة التأكسدية، وهو ما يجعل تنفيق الكاتيونات عملية مطلقة للطاقة. يسبب التدفق الداخلي الطبيعي والمتوسط للكالسيوم من العصارة الخلوية إلى مطرس المتقدرة إزالة استقطاب مؤقت يُصحَّح عبر ضخ البروتونات للخارج.
انتقال الكالسيوم ليس أحادي الاتجاه، ولكن يحدث في كلا الاتجاهين. تسهل خصائص مضخة الكالسيوم SERCA وقناة IP3R المتواجدين على غشاء الشبكة الإندوبلازمية عملية التنظيم بالتغذية الراجعة التي تنسقها وظيفة غشاء MAM. يسمح التخلص من أيونات الكالسيوم بواسطة غشاء MAM بتنميط زماني مكاني لتأشير الكالسيوم لأن أيونات الكالسيوم تغير نشاط IP3R على شاكلة ثنائية الطور. يتأثر SERCA كذلك بواسطة التغذية الراجعة من المتقدرة: يحفز امتصاص أيونات الكالسيوم بواسطة غشاء MAM إنتاج الـATP، وهذا يوفر الطاقة التي تمكن SERCA من إعادة تحميل الكالسيوم إلى الشبكة الإندوبلازمية من أجل تدفق خارجي مستمر للكالسيوم من الشبكة الإندوبلازمية في غشاء MAM. ولهذا غشاء MAM ليس دارئا لا فاعلا لنفائش الكالسيوم، وإنما يساعد في تعديل التأشير بالكالسيوم عبر حلقات تغذية راجعة تؤثر على حركيات الشبكة الإندوبلازمية.
تنظيم تحرير الشبكة الإندوبلازمية للكالسيوم في غشاء MAM عملية حاسمة لأن مجالا محددا فقط من امتصاص أيونات الكالسيوم هو الذي يحافظ على المتقدرة ومنه الخلية في حالة التوازن والاستتباب. تأشير الكالسيوم الكافي داخل العضية مطلوب لتحفيز الأيض بواسطة إنزيمات نازعات الهيدروجين الضرورية في دورة حمض الستريك. حين يتجاوز التأشير بالكالسيوم في المتقدرة عتبة محددة، فإنه يحفز مسارا ذاتيا للاستماتة بشكل جزئي عبر تقويض جهد غشاء المتقدرة المطلوب من أجل الأيض. تدعم دراسات تختبر دور العوامل الداعمة والمضادة للاستماتة هذا النموذج، على سبيل المثال: تم توضيح أن العامل المضاد للاستماتة Bcl-2 يتآثر مع مستقبلات IP3R لتخفيض تعبئة الشبكة الإندوبلازمية بالكالسيوم، ما يؤدي إلى تدفق خارجي منخفض للكالسيوم في غشاء MAM وهو ما يمنع تقويض جهد غشاء المتقدرة وحدوث الاستماتة. نظرا للحاجة إلى التنظيم الدقيق لتأشير الكالسيوم، فمن غير المفاجئ أن اختلال تنظيم كالسيوم المتقدرة له دور في العديد من أمراض التحلل العصبي، وكذلك وفرة بعض مثبطات الورم في غشاء MAM.
الأساس الجزيئي للربط
تقترح أدلة حديثة في تحديد المركبات الرابطة بين غشائي المتقدرة والشبكة الإندوبلازمية أن وظيفة السقالة الخاصة بالجزيئات المكونة لهذه المركبات ثانوية بالنسبة لوظائف غير بنيوية أخرى تقوم بها. في الخميرة، ERMES هو مركب عديدُ البروتين يتكون من بروتينات مقيمة في غشائي الشبكة الإندوبلازمية والمتقدرة، تواجده مطلوب لنقل الليبيدات في غشاء MAM وهو مثال على هذا المبدأ، أحد مكوناته على سبيل المثال هو مكون كذلك لمركبٍ بروتيني آخر مطلوب لدمج براميل بيتا عبر الغشائية في طبقة الليبيد المزدوجة. مع ذلك، لم يتم حتى الآن تحديد نظير لمركب ERMES في خلايا الثدييات. من البروتينات الأخرى المساهمة في السقالة كذلك - ولها وظائف أخرى مستقلة عن الربط في غشاء MAM - نجد بروتينات ميتوفوسين المقيمة في الشبكة الإندوبلازمية والمتقدرة والتي تشكل مركبات متغايرة تعمل على تنظيم عدد مواقع الاتصال بين العضيات، رغم أنه تم تحديد دورها أول مرة في اندماج وانشطار المتقدرات. البروتين المرتبط بالغلوكوز 75 (grp75) هو بروتين آخر ثنائي الوظيفة، ففضلا عن وجوده في مطرس المتقدرة، له وظيفة ثانية كشابرون يربط فيزيائيا قنوات الكالسيوم VDAC وIP3R الخاصة بالمتقدرة والشبكة الإندوبلازمية من أجل نقل فعال وكفء لأيونات الكالسيوم في غشاء MAM. بروتينٌ رابطٌ محتملٌ آخر هو مستقبل سيغما-1 وهو مستقبل غير أفيوني يعمل على استقرار مستقبل IP3R والحفاظ على الاتصال في غشاء MAM أثناء استجابة الإجهاد الأيضي.
غشاء MAM مركز حاسم للتأشير والأيض والنقل في الخلية ويسمح بتكامل فيسيولوجية الشبكة الإندوبلازمية والمتقدرة. اقتران هاتين العضيتين ليس بنيويا فحسب، بل وظيفي كذلك وحاسم للفيسيولوجيا العامة للخلية واستتبابها. يمنح غشاء MAM منظورا عن المتقدرة يحيد ويختلف عن النظرة التقليدية التي مفادها أن هذه العضية وحدة ساكنة تتميز بقدرتها الأيضية وإنتاج الطاقة. وبدل ذلك، يؤكد هذا الغشاء البيني بين الشبكة الإندوبلازمية والمتقدرة، اندماج واشتراك المتقدرات - التي هي ناتج نشوء تعايشي - في مختلف العمليات الخلوية.
التنظيم والتوزيع

تتواجد المتقدرات (والعضيات الشبيهة بها) لدى جميع حقيقيات النوى (باستثناء جنس واحد من الأكسيمونيات هو مونوسيركمنيودات). رغم تصويرها بنيتها عادة على شكل يشبه الفاصولياء، إلا أن المتقدرات تشكل شبكة عالية الحركية في معظم الخلايا التي تخضع فيها للانقسام والاندماج. تشكل جمهرة جميع المتقدرات في خلية معينة الكوندريوم. تختلف المتقدرات في العدد والموقع حسب نوع الخلية. عادة ما توجد متقدرة واحدة في الكائنات وحيدة الخلية، وعدد المتقدرات في الخلايا الكبدية البشرية حوالي 1000-2000 متقدرة لكل خلية وهو ما يشكل خمس حجم الخلية. محتوى الخلايا المتماثلة من المتقدرات يمكن أن يختلف بشكل كبير في حجم وجهد الغشاء، مع اختلافات ناشئة من مصادر منها تجزئة غير متساوية عند انقسامات الخلية، وهذا يؤدي إلى اختلافات ذاتية في مستويات الـATP والعمليات الخلوية مع المسار. يمكن أن تتواجد المتقدرات بين اللييفات العضلية الخاصة بعضلة أو ملفوفة بواسطة سوط حيوان منوي. غالبا ما تشكل المتقدرات شبكة متفرعة ثلاثية الأبعاد مع الهيكل الخلوي داخل الخلية. ارتباطها مع الهيكل الخلوي يحدد شكل المتقدرات الذي يؤثر على الوظيفة كذلك: مختلف بُنى شبكة المتقدرات يمكن أن يوفر لهذه المتقدرات مجموعة متنوعة من الميزات أو السلبيات الفيزيائية والكيميائية والتأشيرية. المتقدرات في الخلايا موزعة دائما على طول أنيبيبات دقيقة وتوزيع هذه العضيات مرتبط كذلك بالشبكة الإندوبلازمية. تقترح أدلة حديثة أن الفيمنتين - وهو أحد مكونات الهيكل الخلوي - ضروري كذلك في ارتباط المتقدرات بالهيكل الخلوي.
الوظيفة
الدور الرئيسي للمتقدرات هو إنتاج عُملة الطاقة الخاصة بالخلية وهي الأدينوسين ثلاثي الفوسفات (ATP) بفسفرة الأدينوسين ثنائي الفوسفات (ADP) عبر عملية التنفس الخلوي، وكذلك تنظيم الأيض الخلوي. مجموعة التفاعلات الرئيسية التي لها دور في إنتاج الـATP تسمى جماعيا دورة حمض الستريك أو حلقة كريبس. مع ذلك للمتقدرة أدوار متعددة أخرى زيادة على إنتاج الـATP.
تحويل الطاقة
الدور الرئيسي للمتقدرات هو إنتاج الـATP، وهو ما يتجلى في تواجد عدد كبير من البروتينات في غشائها الداخلي لهذا الغرض. يحدث ذلك عبر أكسدة منتجات الغلوكوز الرئيسية: البيروفات والناد (NAD) اللذان يُنتَجان في العصارة الخلوية. يُعرف هذا النوع من التنفس الخلوي بالتنفس الهوائي وهو يعتمد على تواجد الأكسجين. حين يكون الأكسجين محدودا تُستقلب نواتج الغلوكوز بواسطة التخمر اللاهوائي وهي عملية مستقلة عن المتقدرة. إنتاج الـATP من الغلوكوز أعلى بحوالي 13 مرة في التنفس الهوائي مقارنة بإنتاجه في التخمر. يمكن لمتقدرات النبات كذلك إنتاج كمية محدودة من الـATP من دون الأكسجين باستخدام ركيزة بديلة هي النتريت. يعبر الـATP الغشاء الداخلي بمساعدة بروتين خاص يسمى مزفي نوكليوتيد الأدينين، ويعبر الغشاء الخارجي عبر البورينات، ويرجع الـADP إلى مطرس المتقدرة عبر نفس الطريق.
البيروفات ودورة حمض الستريك
جزيئات البيروفات الناتجة بواسطة عملية تحلل الجلوكوز تُنقل بشكل نشط عبر الغشاء الداخلي للمتقدرة إلى مطرسها حيث تتم إما أكسدتها وتجميعها مع مرافق الإنزيم-أ لتشكيل ثنائي أكسيد الكربون، أسيتيل مرافق الإنزيم-أ والناد المختزل (NADH)، أو كرسلتها (بواسطة بيروفات كربوكسيلاز) لتشكيل حمض أكسالوأسيتيك. التفاعل الأخير «يملأ» كمية الأوكسالوأسيتات في دورة حمض الستريك، وبذلك هو تفاعل تصليحي، يزيد من قدرة الدورة على استقلاب مرافق الإنزيم-أ حين ترتفع حاجة النسيج (كالعضلات) إلى الطاقة فجأة عبر نشاطها.
في دورة حمض الستريك، يتم توليد جميع الجزيئات الوسيطة (حمض الستريك، حمض إيزوستريك، حمض ألفا-كيتوغلوتارات، حمض السكسينيك، حمض الفوماريك، حمض التفاح وحمض أكسالوأسيتيك) خلال كل لفة من الدورة. إضافة المزيد من أي جزيء من هذه الجزيئات الوسيطة إلى المتقدرة يعني بقاء الكمية المضافة منخفضة في الدورة، زيادة أي جزيء من الجزيئات الوسيطة بصفة فردية يتم تحويله إلى الجزيئات الوسيطة الأخرى، ولذلك فإن إضافة أي واحد منها إلى الدورة له تأثير تصليحي (ملأ) وإزالته له تأثير إفراغي. تفاعلات الملأ والإفراغ هذه تقوم أثناء حدوث الدورة بزيادة أو تخفيض كمية حمض أكسالوأسيتيك المتوفرة التي تتفاعل مع أستيل مرافق الإنزيم-أ لتشكيل حمض الستريك، وهذا بدوره يزيد أو يخفض معدل إنتاج الـATP بواسطة المتقدرة، وبذلك توفره في الخلية للقيام بنشاطاتها.
ينتج أستيل مرافق الإنزيم-أ (أسيتيل كو-أ) من أكسدة حمض البيروفيك أو الأكسدة البيتائية للأحماض الدهنية، وهو الوقود (الركيزة) الوحيد الذي يدخل دورة حمض الستريك، وفي كل لفة من الدورة يُستهلك جزيء واحد من أستيل كو-أ مقابل كل جزيء حمض أكسالوأسيتيك متواجد في مطرس المتقدرة، ولا يتم تجديده أبدا. أكسدة جزء الأسيتات من أسيتيل كو-أ هو ما يُنتِج ثنائي أكسيد الكربون والماء، مع تخزين الطاقة المحررة على شكل ATP.
في الكبد، كرسلة بيروفات العصارة الخلوية إلى أوكسالوأسيتات داخل المتقدرة هو خطوة أولى في مسار استحداث الجلوكوز الذي يحول حمض اللبنيك والألانين منزوع الأمين إلى غلوكوز، تحت تأثير مستويات عالية من الغلوكاغون و/أو الأدرينالين في الدم. هنا، إضافة حمض أكسالوأسيتيك إلى المتقدرة ليس له تأثير تصليحي لأنه تتم إزالة جزيء وسيط في دورة حمض الستريك (حمض التفاح) مباشرة من المتقدرة ليتم تحويله إلى حمض أكسالوأسيتيك في العصارة الخلوية والذي يحول في النهاية إلى غلوكوز، في عملية عكسية تقريبا لتحلل الجلوكوز.
تتواجد إنزيمات دورة حمض الستريك في مطرس المتقدرة باستثناء نازع هيدروجين السكسينات المرتبط بغشاء المتقدرة الداخلي كجزء من المركب 2. تؤكسِد دورة حمض الستريك أستيل كو-أ إلى ثنائي أكسيد الكربون وخلال هذه العملية تُنتِج عوامل مرافقة مختزلة (ثلاث جزيئات NADH وجزيء FADH2) هي مصدر الإلكترونات في سلسلة نقل الإلكترون، وجزيء GTP الذي يحول بسهولة إلى ATP.
NADH وFADH2: سلسلة نقل الإلكترون
طاقة الخزدلة من NADH وFADH2 تُنقل إلى الأكسجين (O2) في عدة مراحل عبر سلسلة نقل الإلكترون. يُنتَج هذان الجزيئان الغنيان بالطاقة داخل المطرس عبر دورة حمض الستريك، لكنهما يُنتجان كذلك في السيتوبلازم بواسطة تحلل الجلوكوز. يمكن نقل المتكافِآت المختزِلة من السيتوبلازم عبر نظام مكوك مالات-أسبارتات من البروتينات متعاكسة التنادل أو يتم إدراجها في سلسلة نقل الإلكترون باستخدام مكوك فوسفات الغليسرول. تقوم المركبات البروتينية في الغشاء الداخلي: (نازعة هيدروجين NADH (يوبيكوينون)، مختزلة الإنزيم المرافق كيو - سيتوكروم سي، وأكسيداز سيتوكروم سي) بعملية النقل وتستخدم الطاقة المحررة في ضخ البروتونات (H+) إلى الحيز بين الغشائي. هذه العملية فعالة، لكن نسبة صغيرة من الإلكترونات يمكن أن تختزل الأكسجين بشكل مُبْتسر، مشكِّلة أنواع الأكسجين التفاعلي مثل فوق الأكسيد. هذا يمكن أن يُسبب إجهاد تأكسدي في المتقدرة ويمكن أن يساهم في انخفاض وظيفة المتقدرة المرتبط بتقدم السن.
مع زيادة تركيز البروتون في الحيز بين الغشائي، يتشكل مدروج كهروكيميائي عبر الغشاء الداخلي. يمكن أن تعود البروتونات إلى المطرس عبر مركب مخلقة الـATP وتُستخدم طاقتها الكامنة في تخليق الـATP من الـADP والفوسفات غير العضوي (Pi). تسمى هذه العملية التناضح الكيميائي ووُصفت لأول مرة بواسطة بيتر ميتشل الذي حصل على جائزة نوبل في الكيمياء على عمله، ولاحقا حصل بول بوير وجون ووكر على جائزة نوبل للكيمياء سنة 1997 لتوضيحهما آلية عمل مخلقة الـATP.
إنتاج الحرارة
تحت ظروف معينة، يمكن للبروتونات معاودة الدخول إلى مطرس المتقدرة دون المساهمة في تخليق الـATP. تسمى هذه العملية بتسرب البروتون أو فك اقتران المتقدرة، وتحدث بسبب سهولة انتشار البروتونات إلى مطرس المتقدرة. ينتج عن هذه العملية تحرير طاقة كامنة غير مستخدمة خاصة بالمدروج الكهروكيميائي للبروتون على شكل حرارة. تتوسط هذه العملية قناة بروتون تسمى ثيرموجينن أو UCP1. الثيرموجينن هو بروتين وزنه الجزيئي 33 كدا واكتُشف أول مرة سنة 1973. يتواجد الثيرموجينن أساسا في النسيج الدهني البني وهو مسؤول عن توليد الحرارة غير المرتبط بالارتعاد. يتواجد النسيج الدهني البني لدى الثدييات ويكون في أعلى مستوياته في بداية حياة الحيوانات السباتية. لدى البشر، يتواجد النسيج الدهني البني عند الولادة ويتناقص مع العمر.
تخزين أيونات الكالسيوم

يمكن أن تُنظِّم تراكيز الكالسيوم الحر في الخلية مجموعةً من التفاعلات وهي مهمة لتوصيل الإشارة في الخلية. يمكن للمتقدرات تخزين الكالسيوم مؤقتا وهي عملية مساهِمة في استتباب كالسيوم الخلية. وقدرتها المتمثلة في الامتصاص السريع للكالسيوم لتحريره لاحقا تجعلها «دارئات عصارية خلوية» جيدة جدا للكالسيوم. الشبكة الإندوبلازمية هي المخزن الرئيسي للكالسيوم، ويوجد تآثر معتبر بين المتقدرة والشبكة الإندوبلازمية فيما يخص الكالسيوم. يُمتص الكالسيوم إلى المطرس بواسطة المنادل الأحادي للكالسيوم الخاص بالمتقدرة الموجود في الغشاء الداخلي للمتقدرة، ويحدث أساسا بسب جهد غشاء المتقدرة. يمكن أن تحدث إعادة تحرير هذا الكالسيوم إلى داخل الخلية عبر بروتين مبادل كالسيوم-صوديوم أو عبر مسارات تحرير الكالسيوم المستحث بالكالسيوم. هذا يمكن أن يولد نفائش أو موجات كالسيوم مع تغييرات كبيرة في جهد الغشاء، والتي يمكنها تنشيط سلسلة من بروتينات نظام الرسول الثاني التي يمكنها تنسيق عملياتٍ مثل تحرير النواقل العصبية في الخلايا العصبية وتحرير الهرمونات في الخلايا الصماوية.
اتضح مؤخرا أن التدفق الداخلي لأيونات الكالسيوم Ca2+ إلى مطرس المتقدرة له دور في آليةٍ لتنظيم الطاقة الحيوية التنفسية عبر السماح للجهد الكهروكيميائي بين جانبي الغشاء «بالنبض» مؤقتا من سيطرة فرق الكمون الكهربائي (ΔΨ) إلى سيطرة الأس الهيدروجيني (PH) وهذا يسهل تخفيض الإجهاد التأكسدي. في العصبونات، تعمل الزيادات المرافقة في كالسيوم العصارة الخلوية والمتقدرة على مزامنة النشاط العصبوني مع أيض الطاقة الخاصة بالمتقدرة. يمكن أن تصل مستويات كالسيوم مطرس المتقدرة حد عشرات ميكرو مول/ل، وهو مستوى ضروري لتنشيط نازعة هيدروجين الإيزوسيترات، وهو أحد الإنزيمات التنظيمية المفتاحية في حلقة كريبس.
وظائف إضافية
تلعب المتقدرة دورا في العديد من الوظائف الأخرى مثل:
- التأشير عبر أنواع الأكسجين التفاعلي الخاصة بالمتقدرة.
- تنظيم الجهد الغشائي.
- الاستماتة - موت الخلية المبرمج.
- تأشير الكالسيوم (بما في ذلك الاستماتة المحدَثَة بالكالسيوم).
- تنظيم الأيض الخلوي.
- بعض تفاعلات تخليق الهيم، (انظر بورفيرين)
- تخليق الستيرويدات.
- التأشير بالهرمونات، المتقدرات حساسة ومستجيبة للهرمونات، ويعود ذلك جزئيا إلى مستقبلات الإستروجين المتقدرية. تتواجد هذه المستقبلات في مختلف الأنسجة وأنواع الخلايا بما في ذلك الدماغ والقلب.
- التأشير المناعي.
- تساهم المتقدرات العصبونية في جودة التنظيم الخلوي بالإبلاغ عن حالة العصبونات إلى الخلايا الدبقية الصغيرة عبر مواصل جسدية متخصصة.
بعض وظائف المتقدرة تتم تأديتها في أنواع محددة من الخلايا، على سبيل المثال: تحتوي المتقدرات في خلايا الكبد على إنزيمات تمكنها من إزالة سمية الأمونيا، وهي فضلات من أيض البروتين. حدوث طفرات في الجينات التي تنظم هذه الوظائف يمكن أن يسبب أمراضا متقدرية.
تنظيم التكاثر الخلوي
تمت دراسة العلاقة بين التكاثر الخلوي والمتقدرات باستخدام خلايا هيلا السرطانية العنقية. تحتاج الخلايا الورمية إلى كمية كبيرة من الـATP في سبيل تخليق المركبات النشطة حيويا مثل الليبيدات، البروتينات والنوكليوتيدات من أجل نمو الخلية السريع. يُولَّد معظم الـATP في الخلايا الورمية عبر الفسفرة التأكسدية. أظهر اعتراض عملية الفسفرة التأكسدية توقفا في دورة الخلية وهذا يوحي بأن المتقدرات تلعب دورا في نمو الخلية وتكاثرها. إنتاج الـATP في المتقدرة حياتيٌ كذلك بالنسبة لانقسام وتمايز الخلية أثناء العدوى وذلك فضلا عن أهميته بالنسبة لوظائف الخلية الأساسية بما في ذلك تنظيم حجم الخلية، تركيز المذاب ومعمارية الخلية. تختلف مستويات الـATP بين مختلف مراحل دورة الخلية وهذا يشير إلى علاقة بين توفر الـATP وقدرة الخلية على الدخول في دورة خلوية جديدة. دور الـATP في الوظائف الأساسية للخلية يجعل دورة الخلية حساسة للتغيرات في توافر الـATP المخلق في المتقدرة. يدعم اختلاف مستويات الـATP في المراحل المختلفة من دورة الخلية فرضية أن المتقدرات تلعب دورا مهما في تنظيم دورة الخلية. رغم أن هذه الآليات الخاصة بين المتقدرات وتنظيم دورة الخلية لم يتم فهمها بعد، أظهرت دراسات أن نقاط مراقبة دورة الخلية قليلة الطاقة تراقب قدرة الطاقة قبل الشروع في دورة أخرى من الانقسام الخلوي.
الجينوم
تحتوي المتقدرات على جينومها الخاص التي حصلت عليه من البكتيريا عن طريق التعايش الجواني. مع ذلك، جينوم المعايش الجواني السلف فقد معظم جيناته لدرجة أن جينوم المتقدرة (متقدروم) أصبح أقل الجينومات احتواء على الجينات بين الكائنات.
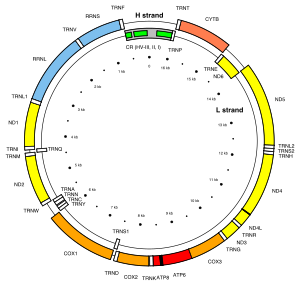
الجينوم المتقدري البشري هو جزيء دنا دائري يتكون من حوالي 16 ألف زوج قاعدي، ويشفِّر 37 جينا: 13 وحدة فرعية من المركبات التنفسية 1 و3 و4 و5، 22 رنا ناقل متقدري (للعشرين حمض أميني القياسية بالإضافة إلى جينين إضافيين لليوسين والسيرين و2 للرنا الريبوسومي. يمكن أن تحتوي متقدرة واحدة على نسختين إلى عشر نسخ من الدنا الخاص بها.
لدى بدائيات النوى، توجد نسبة كبيرة من الدنا المشفِّر للبروتين وغياب للتكرارات. تُنسخ جينات المتقدرة كنسخ متعددة الجينات والتي تُقص بعدها وتُضاف إليها ذيول عديد الأدينلات لإنتاج عدة نسخ رنا رسول ناضجة. لا تُشفَّر جميع البروتينات الضرورية في المتقدرة بواسطة جينومها، بل معظمها يُشفر بواسطة جينات في نواة الخلية ويتم نقل البروتينات الناتجة إلى المتقدرة. عدد الجينات الدقيق الموجودة في جينوم النواة والمتقدرة يختلف بين الأنواع. معظم جينومات المتقدرة دائرية مع وجود استثناءات تم الإبلاغ عنها. بشكل عام، يفتقد دنا المتقدرة للإنترونات، كما هو الحال في جينوم المتقدرة البشري، مع ذلك لوحِظ وجود الإنترونات في دنا المتقدرة الخاص ببعض حقيقيات النوى مثل الخميرةوالطلائعيات منها ديكتيوستيليوم دسكويديوم. تتواجد التسلسلات المشفِّرة للرنا الناقل بين المناطق المشفِّرة للبروتين، وأثناء النسخ تتخذ جزيئات الرنا الناقل شكل حرف L الذي تتعرف عيه إنزيمات معينة وتقصه. لجينات الرنا الناقل المتقدري تسلسللات تختلف عن تسلسلات الرنا الناقل النووي، لكن تم العثور على نظائر لجزيئات الرنا الناقل المتقدرية في الكروموسومات النووية ذات تسلسل عالي التماثل.
لدى الحيوانات، جينوم المتقدرة هو عادة كرموسومٌ دائريٌ وحيدٌ طوله حوالي 16 ألف زوج قاعدي ويحتوي 37 جينا. هذه الجينات عالية الانحفاظ يمكن أن تختلف في مواضعها. هذا النمط غير متواجد لدى قمل الإنسان، وبدل ذلك جينومها مرتب في 18 كروموسوم صغير، طول كل واحد منها حوالي 3-4 آلاف زوج قاعدي ويشفِّر من جين إلى ثلاث جينات. هذا النمط متواجد كذلك لدى القمل الماص ولكن ليس لدى القمل العاض، وسبب هذا الاختلاف في نمط دنا المتقدرة غير معروف. لوحظ حدوث إعادة التركيب الجيني بين الكروموسومات الصغيرة.
كود جيني بديل
| الكائن | الكودون | التشفير القياسي | تشفير المتقدرة |
|---|---|---|---|
| الثدييات | AGA, AGG | أرجنين | كودون توقف |
| الفقاريات | AGA, AGG | أرجنين | سيرين |
| الفطريات | CUA | ليوسين | ثريونين |
| جميع الأنواع بالأعلى | AUA | إيزوليوسين | ميثيونين |
| UGA | كودون توقف | تريبتوفان |
رغم التنبؤِ باختلافات طفيفة في الشيفرة الجينية القياسية سابقا، إلا أنه لم يُكتشف أي منها حتى سنة 1979 حين اكتشف باحثون يدرسون جينات المتقدرة البشرية أنهم استخدموا شيفرة بديلة. مع ذلك، متقدرات حقيقيات النوى - بما في ذلك معظم النبات - تستخدم الشيفرة القياسية. تم اكتشاف العديد من التغيرات الطفيفة منذ ذلك الحين، بما في ذلك العديد من الشيفرات البديلة في المتقدرات. زيادة على ذلك، الكودونات: AUA وAUC وAUU جميعها كودونات تسمح ببدء النسخ.
يجب أن تُعتبر بعض هذه الاختلافات تغيُّرات كاذبة في الشيفرة الجينية بسبب ظاهرة تحرير الرنا الشائعة في المتقدرات. لدى النباتات العليا، يُعتقد أن الكودون CGG يشفِّر الحمض الأميني تريبتوفان وليس الأرجنين، لكن اكتُشِف أن الكودون في الرنا المعالَج هو UGG وهذا يتوافق مع الشيفرة الجينية القياسية للتريبتوفان. الشيفرة الينية لمفصليات الأرجل خضعت لتطورٍ موازٍ داخل شعبة معينة، حيث تترجِم بعض الكائنات بشكل فريد الكودون AGG إلى لايسين.
تطور وتنوع
تملك جينومات المتقدرة عدد جينات أقل بكثير من جينات البكتيريا والتي يُعتقد أن المتقدرة انحدرت منها. رغم أن بعض هذه الجينات فُقِد نهائيا، تم نقل العديد من الجينات الأخرى إلى النواة مثل جينات الوحدات الفرعية للمركب التنفسي 2. يُعتقد أن هذا الأمر شائع نسبيا خلال زمن التطور. تملك بعض الكائنات مثل الكريبتوسبوريديوم متقدراتٍ لا تحتوي على أية جزيئات دنا، وهذا على الأرجح لأن جميع جيناتها فُقِدت أو تم نقلها إلى النواة. في الكريبتوسبوريديوم، للمتقدرات نظام تخليق ATP مختلف يجعل من هذا الكائن الطفيلي مقاوما للعديد من مثبطات المتقدرة الكلاسيكية مثل سيانيد، أزيد وأتوفاكوين.
تضاعف وتوريث
تنقسم المتقدرة بواسطة الانقسام الثنائي، بشكل مماثل لانقسام خلية البكتيريا، ويختلف تنظيم هذا الانقسام بين حقيقيات النوى. يرتبط نمو وانقسام العديد من حقيقيات النوى أحادية الخلية بدورة الخلية لديها، على سبيل المثال: يمكن أن تنقسم متقدرة واحدة في وقت متزامن مع النواة، ويجب أن تُراقَب عملية الانقسام والانفصال هذه بإحكام لكي تحصل كل خلية بنت على متقدرة واحدة على الأقل. لدى حقيقيات النواة الأخرى كالثدييات مثلا، يمكن للمتقدرات مضاعفة الدنا الخاص بها والتضاعف استجابة لاحتياجات الخلية من الطاقة، بدل أن يحدث ذلك بشكل متزامن مع دورة الخلية. تنمو المتقدرات وتنقسم حين ترتفع احتياجات الخلية من الطاقة، وحين يكون استخدام الطاقة منخفضا تُفكَّك المتقدرات أو تصبح غير نشطة. لدى حقيقيات النوى هذه - وعلى عكس حقيقيات النوى وحيدة الخلية - يبدو أن تقسيم المتقدرات بين الخلايا البنت يكون عشوائيا أثناء انقسام السيتوبلازم. كشف فهمُ ديناميكية المتقدرة - التي توصف على أنها موازنة بين اندماج وانقسام المقدرة - أن التغيرات الوظيفية والبنيوية في مورفولوجية المتقدرة عوامل مهمة في أسباب الأمراض المرتبطة بالعديد من الحالات المرضية.
اعتمدت فرضية الانقسام الثنائي للمتقدرة على تصويرٍ بواسطة المجهرية الفلورية وبواسطة المجهرية الإلكترونية النافذة التقليدية. دقة المجهرية الفلورية حوالي 200 نانومتر وهي غير كافية لتمييز التفاصيل البنيوية مثل غشاء المتقدرة المضاعف اثناء انقسام المتقدرة أو حتى تمييز المتقدمات فرديا حين تكون مجموعة منها على مقربة من بعضها البعض. المجهرية الإلكترونية النافذة التقليدية لديها بعض المحدوديات التقنية في التأكد من انقسام الخلية. استُخدِم التصوير المقطعي البردي الإلكتروني حديثا لتصوير انقسام المتقدرة في خلايا مجمدة مميهة سليمة، وتم اكتشاف أن المتقدرات تنقسم عبر التبرعم.
جينات متقدرة واحدة لا تتم وراثتها بنفس آلية الجينات الموجودة في النواة، فعادة ما تُورث المتقدرات من أحد الوالدين فقط. لدى البشر، حين تُخصَّب بويضة بواسطة نطفة تُساهم نواة البويضة ونواة النطفة بالتساوي في المحتوى الجيني لنواة اللاقحة (الزيجوت). على عكس ذلك لدى المتقدرات عادة ما يأتي دنا المتقدرة من البويضة فقط. متقدرات النطفة تدخل البويضة لكنها لا تساهم بالمعلومات الجينية للجنين. بدل ذلك، تُعلَّم متقدرات الأب بواسطة اليوبيكويتين لتحديدها لاحقا من أجل تدميرها داخل الجنين. تحتوي البويضة على عدد قليل نسبيا من المتقدرات، لكن هذه المتقدرات هي من تنجو وتنقسم لتستعمر خلايا الكائن البالغ. نتيجة لذلك - وفي معظم الحالات - تورث المتقدرات من الأمهات، وهو نمط يُعرف باسم الوراثة الأمومية ويتواجد لدى معظم الكائنات بما في ذلك معظم الحيوانات. مع ذلك، يمكن أن تورَث المتقدرات لدى بعض الأجناس عن طريق الأب، وهو الحال لدى بعض النباتات المخروطية باستثناء أشجار الصنوبر والطقسوس. بالنسبة لبلحيات البحر، تحدث الوراثة الأبوية فقط بين ذكور هذه الأجناس. تم اقتراح أن وراثة المتقدرات من الأب لدى البشر تحدث بنسبة صغيرة جدا. واقتُرح سنة 2012 في مجلة علم الأحياء الحالي أن المتقدرات التي تخفض مدة حياة الذكر تبقى في النظام لأنها تورث من الأم فقط. في المقابل يُزيل الاصطفاء الطبيعي المتقدرات التي تخفض من عمر الإناث، وعليه انتقال مثل تلك المتقدرات إلى الجيل التالي ضعيف جدا، وهذا قد يوحي بأن إناث البشر وإناث الحيوانات تميل للعيش أطول من الذكور، ويدعي كُتّاب هذه الورقة أن هذا تفسير جزئي لكون النساء تعيش متوسط عمر أكبر بخمس إلى ستة أعوام من الرجال.
تؤدي الوراثة من أحد الأبوين فقط إلى فرصة ضعيفة لحدوث إعادة التركيب الجيني بين مختلف سلالات المتقدرات، رغم أن متقدرة واحدة يمكن أن تحتوي على 2-10 نسخة من الدنا الخاص بها. لهذا السبب، يُعتقد أن دنا المتقدرة يتضاعف بواسطة انقسام ثنائي. توجد دراسات تُظهر أدلة على حدوث إعادة التركيب الجيني في دنا المتقدرة، ومن الواضح أن الإنزيمات الضرورية لهذه العملية متواجدة في خلايا الثدييات. زيادة على ذلك، تقترح أدلة أنه يمكن لمتقدرات الحيوانات أن تخضع لعملية إعادة التركيب الجيني. البيانات خلافية حول حدوثها لدى البشر، رغم وجود دليل غير مباشر على حدوثها. إن كانت إعادة التركيب الجيني لا تحدث، فإن جميع تسلسل دنا المتقدرة يمثل نمطا فردانيا واحدا، وهذا أمر مفيد في دراسة التاريخ التطوري للتجمعات السكانية.
الكائنات التي تخضع للوراثة من أحد الأبوين فقط والتي يوجد فيها إعادة تركيب جيني صغير أو منعدم يمكن أن تكون عرضة لسقاطة مولر، وهي تراكمٌ غير قابل للعكس للطفرات المؤذية حتى فقدان الوظيفة. تتجنب المتقدرات لدى الحيونات هذا المصير عبر عملية تطورية تُعرف بعنق زجاجة دنا المتقدرة. يستغل عنق الزجاجة عمليات العشوائية في الخلية لزيادة اختلاف الخلية - إلى - الخلية في كمية الطافر مع تطور الكائن: تُنتِج بويضة واحدة ذات نسبة معينة من دنا المتقدرة الطافر جنينًا تملك فيه مختلف الخلايا كميات طافر مختلفة. بعد ذلك يعمل مستوى اصطفاء الخلية على إزالة الخلايا التي تحتوي على دنا المتقدرة الأكثر طفورا، وهذا يؤدي إلى استقرارٍ أو تخفيضٍ لكمية الطافر بين الأجيال. الآلية خلف عملية عنق الزجاجة محل نقاش، مع وجود دراسات رياضياتية وتجريبية تلوية توفر أدلة على توليفة لتجزئة عشوائية لدنا المتقدرة أثناء الانقسام الخلوي مع تقلبِ (تجدد) جزيئات دنا المتقدرة عشوائي داخل الخلية.
ترميم الدنا
يمكن للمتقدرة ترميم الدنا المتضرر بالأكسدة بواسطة آليات مماثلة لتلك التي تحدث في نواة الخلية. تشفَّر البروتينات المستخدمة في ترميم دنا المتقدرة بواسطة الجينات النووية، ويتم نقلها إلى المتقدرات. تشمل مسارات ترميم الدنا في متقدرات الثدييات: ترميم استئصال القاعدة، ترميم شرخ السلسلة المزدوجة، العكس المباشر وترميم الدنا غير المتطابق. يمكن تجاوز تضرر الدنا بدل إصلاحه وذلك بواسطة تخليق عبر-الرابطة. من بين مختلف المسارات المتعددة لترميم الدنا في المتقدرة، يُعتبر ترميم استئصال القاعدة أكثر المسارات التي تمت دراستها بشكل شامل. يحدث ترميم استئصال القاعدة بواسطة سلسلة من الخطوات المحفَّزة إنزيميا والتي تشمل التعرف على قاعدة الدنا المتضررة وإستئصالها، إزالة الموقع اللاخطوي الناتج، إنهاء المعالجة، ملأ الفراغ والربط. أحد الأضرار الشائعة في دنا المتقدرة والذي يرمم بواسطة استئصال القاعدة هو 8-أوكسو غوانين الناتج عن أكسدة الغوانين.
تُرمَّم شروخ السلسلة المزدوجة بواسطة ترميم التأشيب المتماثل في كل من دنا المتقدرة الخاص بالثدييات والنبات. يمكن أن ترمم كذلك شروح السلسلة المزدوجة في دنا المتقدرة بواسطة ربط النهاية المتوسط بالتنادد المكروي. رغم وجود دليل على عمليات الترميم بالعكس المباشر وترميم الدنا غير المتطابق في دنا المتقدرة، لا تزال هذه العمليات غير موصوفة ومحددَّة الخصائص بشكل جيد.
انعدام دنا المتقدرة
تملك خلايا حقيقيات النوى في العادة دنا المتقدرة، لكن توجد متقدرات لا تملك دنا خاصا بها مثل تلك المتواجدة لدى الطفيليات البحرية السوطيات الدوارة من جنس أمويِبوفيرا، يملك هذا الكائن الدقيق - أ.سيراتي - متقدرات وظيفية ينعدم فيها الدنا. جينوم المتقدرات الخاص بالأجناس قريبة الصلة من هذا الجنس مازال يحتوي على ثلاث جينات، لكن لدى أ.سيراتي لا يوجد سوى جين متقدرة واحد - هو الوحدة الفرعية 1 من أكسيداز السيتوكروم سي - وقد تم نقله إلى جينوم النواة.
دراسات الوراثيات السكانية

الغياب شبه التام لإعادة التركيب الجيني في دنا المتقدرة يجعله مصدرا مفيدا للمعلومات للعلماء المختصين في الوراثيات السكانية وفي علم الأحياء التطوري. لأن جميع دنا المتقدرة يورث كوحدة واحدة - أو نمط فرداني - يمكن للعلاقات بين دنا المتقدرة لمختلف الأفراد أن تُمثل كشجرة جينية، ويمكن أن تُستخدم الأنماط في هذه الأشجار لاستنتاج التاريخ الطوري للجمهرات السكانية. والمثال الكلاسيكي على ذلك في علم الوراثة التطوري البشري، حيث يمكن استخدام الساعة الجزيئية لتوفير تاريخ حديث لحواء الميتوكوندرية. يفسَّر هذا غالبا على أنه سند قوي لنظرية انتشار البشر الحديث من إفريقيا. مثال بشري آخر هو سَلسَلة دنا المتقدرة من عظام النياندرتال. فُسِّر البعد التطوري الكبير نسبيا بين تسلسلات دنا المتقدرة الخاص بالنياندرتال والإنسان الحي حاليا بعدم حدوث تهجين وتزاوج بينهما.
مع ذلك لا يعكس دنا المتقدرة سوى تاريخ الإناث في التجمع السكاني ولهذا يمكن أن لا يمثل تاريخ التجمع السكاني ككل. يمكن التغلب على هذا الإشكال جزئيا عبر استخدام التسلسلات الجينية الأبوية مثل المنطقة التي لا تخضع لإعادة التركيب الجيني في الكروموسوم Y. بشكل عام، لا يمكن سوى للدراسات التي تشمل الدنا النووي أيضا تقديم تاريخ تطوري شامل للتجمعات السكانية.
أبلغت قياسات حديثة للساعة الجزيئية لدنا المتقدرة عن حدوث طفرة واحدة كل 7884 سنة منذ عهد أحدث سلف مشترك بين البشر والقرود، وهو ما يتوافق مع تقديرات معدل طفرات الدنا الصبغي الجسمي (10−8 لكل قاعدة لكل جيل).
الاضطراب الوظيفي والمرض
أمراض المتقدرة
تضرُّرُ المتقدرات والخلل الوظيفي الناتج عن ذلك عامل مهم في مجموعة من الأمراض البشرية وذلك بسبب تأثيرها في أيض الخلية. عادة ما تتجلى الاضطرابات المتقدرية على أنها اضطرابات عصبية مثل التوحد. كما يمكنها أن تتجلى على شكل: اعتلال عضلي، السكري، اعتلال الغدد الصماء المتعدد، والعديد من الاضطرابات الجهازية الأخرى. تشمل الأمراض التي تحدث بسبب طفرة في دنا المتقدرة: متلازمة كيرنز ساير، متلازمة ميلاس واعتلال ليبر العصبي البصري الوراثي. في معظم الحالات، تنتقل هذه الأمراض بواسطة الأم إلى أبنائها وذلك لأن اللاقحة تحصل على متقدراتها - ومنه دنا المتقدرة - من البويضة. يُعتقد أن سبب أمراضٍ مثل: متلازمة كيرنز ساير، متلازمة بيرسون وشلل العين التقدمي الخارجي المزمن يعود إلى إعادات تنظيم دنا المتقدرة واسعة النطاق، بينما أمراض أخرى مثل: متلازمة ميلاس، اعتلال ليبر العصبي البصري الوراثي، الصرع الرمعي العضلي ذو الألياف الرثة (MERRF) وأخرى سببها طفرات نقطية في دنا المتقدرة.

في أمراض أخرى، تؤدي عيوب في الجينات النووية إلى الاختلال الوظيفي لبروتينات المتقدرة، وهي الحالة في: رنح فريدريخ، الشلل النصفي التشنجي الموروث وداء ويلسون. تورث هذه الأمراض بطريقة سيادية، وهو ما ينطبق على معظم الأمراض الوراثية الأخرى. يمكن لمجموعة متنوعة من الاضطرابات أن تحدث بواسطة طفرات نووية لإنزيمات الفسفرة التأكسدية مثل عوز مرافق الإنزيم Q10 ومتلازمة بارث. يمكن أن تتآثر المؤثرات البيئية مع الاستعدادات الوراثية وتسبب مرضا متقدريا. على سبيل المثال قد يكون هنالك رابط بين التعرض لمبيد آفات والإصابة اللاحقة بمرض باركنسون. من الأمراض الأخرى التي من أسبابها الاختلال الوظيفي للمتقدرة: الفصام، الاضطراب ثنائي القطب، الخرف، مرض آلزهايمر،مرض باركنسون، الصرع، السكتة الدماغية، الأمراض القلبية الوعائية، متلازمة التعب المزمن، التهاب الشبكية الصباغي والسكري.
يلعب الإجهاد التأكسدي المتوسَّط بالمتقدرة دورا في اعتلال عضلة القلب في سكري النوع الثاني. زيادة توصيل الأحماض الدهنية إلى القلب تزيد من استهلاك الخلايا العضلية القلبية لها، وتنتج عن ذلك زيادةٌ في أكسدة الأحماض الدهنية في هذه الخلايا. تزيد هذه العملية من المتكافِآت المختزِلة المتوفرة لسلسلة نقل الإلكترون في المتقدرة، ما يزيد في النهاية من إنتاج أنواع الأكسجين التفاعلي (ROS). تزيد أنواع الأكسجين التفاعلي من بروتينات فك اقتران (UCP) وتقوي تسرب البروتون عبر مزفي نوكليوتيد الأدينين (ANT)، وهي توليفة تفك اقتران المتقدرات. بعد ذلك، يزيد فك الاقتران من استهلاك المتقدرات للأكسجين، ما يزيد من أكسدة الأحماض الدهنية، وهو ما يُنشِئ دورة ضارة من فك الاقتران، ورغم زيادة استهلاك الأكسجين لا يزيد إنتاج الـATP بشكل متناسب لأن المتقدرات مفكوكة الاقتران. ينتج عن التوفُّر القليل للـATP في النهاية عوز في الطاقة يتجلى في فعاليةٍ قلبيةٍ منخفضةٍ واختلال وظيفي في الانقباض. ما يزيد من تعقيد المشكل هو أن تحرير الشبكة الإندوبلازمية العضلية المعتل للكالسيوم وانخفاض استرداد المتقدرة له يحد من ذروة مستويات العصارة الخلوية من أيون مهم أثناء الانقباض. يزيد التركيز المنخفض للكالسيوم داخل المتقدرة من نشاط نازعة الهيدروجين وتخليق الـATP. لذلك بالإضافة إلى انخفاض تخليق الـATP بسبب أكسدة الأحماض الدهنية، يتعرض تخليق الـATP للاعتلال بسبب تأشير الكالسيوم الضعيف وهذا يسبب مشاكل قلبية لمرضى السكري.
علاقة محتملة بالشيخوخة
نظرا لدور المتقدرة كمركز لتوليد الطاقة في الخلية، يمكن أن يكون هنالك بعض التسرب لإلكتروناتٍ عالية الطاقة في السلسلة التنفسية لتشكيل أنواع الأكسجين التفاعلي. ويُعتقد أن هذا يمكن أن يُنتِج إجهادا تأكسديا معتبرا في المتقدرات ذات المعدل العالي في طفرات الدنا المتقدري الخاص بها. فرضية وجود روابط بين الشيخوخة والإجهاد التأكسدي ليست جديدة وتم اقتراحها سابقا سنة 1956، ثم ظهرت نسخة محسنة منها باسم نظرية الجذور الحرة المتقدرية للشيخوخة. يُعتقد أن دورة ضارة تحدث - بينما يؤدي الإجهاد التأكسدي إلى طفرات في دنا المتقدرة - والتي يمكن أن تؤدي إلى اضطرابات إنزيمية والمزيد من الإجهاد التأكسدي.
يمكن أن يحدث عدد من التغيرات في المتقدرة أثناء عملية التشيخ. تُظهر أنسجة من المرضى كبار السن انخفاضا في النشاط الإنزيمي لبروتينات السلسلة التنفسية. ومع ذلك دنا المتقدرة الطافر لم يوجد سوى في 0.2% من الخلايا العتيقة جدا. افتُرِض أن الحذف الكبير في جينوم المتقدرة يؤدي إلى مستويات عالية من الإجهاد التأكسدي وموت الخلايا العصبية في مرض باركنسون.
في الثقافة الشعبية
في رواية الفنتازيا العلمية لمادلين لانغل الصادرة سنة 1973 المعنونة «ريح في الباب»، متقدرات الشخصية الرئيسية تشارلز والاس موري تسكنها مخلوقات تعرف باسم «فاراندولاي». وفي الرواية كذلك تسافر شخصيات أخرى داخل متقدرات موري.
في رواية أدب الرعب «الطفيلي إيف» بواسطة الكاتب هيداكي سينا، تُصوَّر المتقدرات على أنها تملك بعض الوعي وقدرات التحكم في العقل، وتحاول استخدام هذه القدرات لتجاوز حقيقيات النوى في كونها هيئة الحياة السائدة. تم تبني هذه الرواية في فلم ولعبة فيديو ولعبة ثانية مبنية جميعها على افتراض مماثل.
في سلسلة أفلام حرب النجوم، تمنح الكائنات الدقيقة التي يشار إليها باسم «ميدي-كلوريانز» بعض الشخصيات القدرة على الإحساس بالقوة واستخدامها. جورج لوكاس مخرج فيلم 1999 حرب النجوم الجزء الأول: تهديد الشبح الذي تم فيه تقديم الميدي-كلوريانز، وصف هذه الأخيرة بأنها «تمثيل عام غير دقيق للمتقدرات». البكتيريا غير الخيالية ميديكلوريا حصلت على اسمها لاحقا من الميدي-كلوريانز الخاصة بفيلم حرب النجوم.
كنتيجة لاشتهار المتقدرة في التعليم العلمي الحديث الأمريكي، أصبحت عبارة "المتقدرات هي مركز طاقة الخلية" ميم إنترنت.
الأصل والتطور
يُعتبر تطوُّر الخلايا حقيقية النواة - التي تحتوي على نواة ومناطق حيّزية مغلفة بالغشاء - واحدًا من أكثر الأحداث الغامضة في تطور الحياة على سطح الأرض. وقد شكَّل ظهور الميتوكوندريا نقلة حاسمة في هذه العملية؛ إذ يُعتقد أن هذه العضيّات قد تشكلت حين بدأت خلية بكتيرية العيشَ داخل خلية مضيفة بدائية، ما يُعَدّ أحد أشكال التعايش الداخلي، وهو بمثابة علاقة منفعة متبادلة، يعيش فيها كائن حي بداخل كائن آخر. مِن المعتقَد أن البكتيريا قد زوّدت الخلية المضيفة بكمية إضافية من الطاقة، ومن ثم نتجتْ عن التفاعل بينهما خليّة حقيقية النواة، احتوت على جينات، يعود أصلها إلى كل من الخلية البدائية، والبكتيريا. قدّم الباحثان بيتيس وجابالدون بحثهما على أن الخلية المضيفة التي تطوَّرت منها حقيقيات النوى كانت تحتوي في الأصل على جينات تعود إلى مجموعة مختلفة من المصادر، وذلك قبل التعايش الداخلي للميتوكوندريا؛ ما يشير إلى أن الميتوكوندريا تطورت في وقت لاحق لعملية تطور حقيقيات النوى عما كان يُعتقد في السابق.
تاريخ البحث والاكتشاف
نُشرت أول ملاحظات لهياكل داخل خلوية اعتُقد أنها تمثل المتقدرات في عقد 1840. وفي سنة 1890 حدد ريتشارد ألتمان هذه الهياكل على أنها عضيات خلوية وسماها «بيوبلاست». صيغ المصطلح الأجنبي «ميتوكوندريا» بواسطة كارل بيندا سنة 1898. واكتشف ليونور ميخائيلس إمكانية استخدام خضرة يانوس بي كملون فوق حيوي للمتقدرات سنة 1900. في سنة 1904 قام فريدريش ميفيس بأول ملاحظة مسجلة للمتقدرات في خلايا نبات الزنبق الأبيض «النيلوفر الأبيض» وفي سنة 1908 اقترح - مع كلوديوس ريغو- أنها تحتوي على بروتينات وليبيدات. بنجامين كينغسبري هو أول من ربط المتقدرات بتنفس الخلية سنة 1912، لكن بشكل شبه حصري عبر ملاحظات مورفولوجية. في سنة 1913، ربط أوتو فاربورغ جسيماتٍ من مستخلصاتِ كبد الكابياء الخنزيرية بالتنفس، والتي سُميت «غرانا». فاربورغ وهاينريش فيلاند -ا لذي افترض وجود آلية مماثلة- اختلفا على الطبيعة الكيميائية للتنفس. واستغرق الأمر حتى سنة 1925 عندما اكتشف ديفيد كيلين السيتوكرومات ليتم وصف السلسلة التنفسية.
أثبتت تجارب أجريت سنة 1939 باستخدام خلايا عضلية مفرومة أن التنفس الخلوي باستخدام ذرة أكسجين واحدة يمكن أن يشكل جزيئي ATP، وفي سنة 1941 طور فريتس ليبمان مفهوم أن روابط الفوسفات في الـATP هي شكل من الطاقة في الأيض الخلوي. في الأعوام التالية، أكتُشفت تفاصيل أكثر حول التنفس الخلوي، رغم أن علاقته مع المتقدرات لم تكن معروفة. سمح ابتكار تجزيء النسيج بواسطة ألبير كلود بعزل المتقدرات من بقية أجزاء الخلية وإجراء الدراسات عليها وحدها، واستنتج ألبير كلود سنة 1946 أن سيتوكروم أكسيداز وإنزيمات أخرى مسؤولة عن السلسلة التنفسية تتواجد في المتقدرات. اكتشف يوجين كينيدي وألبرت ليننغر سنة 1948 أن المتقدرات هي موقع الفسفرة التأكسدية لدى حقيقيات النوى، ومع مرور الوقت تم تطوير طريقة التجزيء أكثر وتحسنت جودة المتقدرات المستخلصة وتم اكتشاف تواجد عناصر أخرى من السلسلة التنفسية في المتقدرات.
ظهرت أول صورة عالية الدقة بالمجهر الإلكتروني سنة 1952، وأصبحت الطريقة الأفضل في تصوير المتقدرات بدل صباغ خضرة يانوس. أدى هذا إلى تفاصيل أكثر دقة في بنية المتقدرات، بما في ذلك التأكيد على أنها محاطة بغشاء، وكشف المجهر الإلكتروني كذلك وجود غشاء ثاني داخل المتقدرات والذي يتطوى في تلافيف تقسِّم الغرفة الداخلية للمتقدرة، وأظهر أن حجم المتقدرات وشكلها يختلف من خلية إلى أخرى. صيغ المصطلح الشهير "مركز طاقة الخلية" بواسطة فيليب سيكيفيتز سنة 1957. وفي سنة 1967 اكتُشف أن المتقدرات تحتوي على ريبوسومات، وفي سنة 1968 طُوِّرت طرق لموضعة جينات المتقدرة، واكتملت الخريطة الجينية والفيزيائية لدنا متقدرة الخميرة سنة 1976.
انظر أيضًا
ملاحظات
مراجع
| النظام الغشائي الداخلي | |
|---|---|
| الهيكل الخلوي | |
| متكافل داخلي | |
| أجزاء داخلية أخرى | |
| أجزاء خارجية | |
|
مكونات الخلية الحيوانية النموذجية
| ||
|---|---|---|
(1) النوية (2) النواة |
||
| التصنيفات الطبية | |
|---|---|
| المعرفات الخارجية |
|