بروتين أصفر
البروتين الدهني هو نوع من البروتين الصباغ مجمع موجود في التمثيل الضوئي الكائنات الحية مثل الطحالب وبعض الحشراتوهي تشير إلى أي بروتين يحتوي على البيليروبين حاملفي النباتات والطحالب، وظيفتها الرئيسية هي جعل عملية التمثيل الضوئي ضوء تراكم المطلوبة أكثر فعالية؛ في الحشرات، فإنها تلعب دورا في النمو والتنمية بعض من هذه الخصائص، بما في ذلك حساسية الضوء، ضوء محاصرة ومضان، لجعلها مناسبة للاستخدام في التصوير البيولوجي والمؤشرات؛phycobiliprotein تمتلك خصائص مضادة الأكسدة، ومكافحة الشيخوخة، المضادة للالتهابات، الخعلى الرغم من أن البحث عن البيليروبين يمكن أن تعزى إلى 1950 سنوات، البيليروبين هو إعاقة بسبب المشاكل الهيكلية، وعدم وجود طريقة لفصل البيليروبين واحد ومعلومات محدودة عن دراسة البروتين الدهني أيضا تركز أساسا على phycobiliprotein ؛ ومع ذلك، فإن التقدم في التكنولوجيا والأساليب، فضلا عن اكتشاف أنواع مختلفة من الإنزيمات المشقوقة قد جذبت اهتمام جديد في دراسة البروتينات الصفراوية
المهام
في النباتات والطحالب
اكتشاف البروتينات الصفراوية في النباتات والطحالب هو نظام الصباغ الذي يهدف إلى الكشف عن امتصاص الضوء اللازم لعملية التمثيل الضوئي. طيف امتصاص البروتين الصفراوي يكمل طيف الامتصاص الضوئي أصباغ أخرى مثل الكلوروفيل أو كاروتين أصباغ الكشف عن امتصاص الطاقة من أشعة الشمس؛ الطاقة ثم تحويلها إلى الكلوروفيل من خلال نقل الطاقة الداخلية وبحسب تاكاشي هيراتا وغيرها 2002 سنوات، chromophores بعض phycobiliproteins هي المسؤولة عن الأنشطة المضادة للأكسدة phycobiliproteins ، phycocyanin كماعندما يسببها الكولاجين أدينوسين ثلاثي الفوسفات، phycocyanin حامل اللون يمنع تراكم الصفائح الدموية في phycocyanin المقابلة phycocyanin
في الحشرات
في الحشرات، تعمل الليبوكالينات البيليبروتين بشكل عام لتسهيل تغيير الألوان أثناء التمويه، ولكن تم العثور على أدوار أخرى للبيليبروتين في الحشرات. تم افتراض وظائف مثل منع التلف الخلوي، وتنظيم guanylyl cyclase مع biliverdin ، من بين الأدوار الأخرى المرتبطة بالصيانة الأيضية، ولكن لم يتم إثباتها بعد. في دودة قرن التبغ، تم العثور على biliprotein insecticyanin (INS) يلعب دورا حاسما في التطور الجنيني، حيث لوحظ امتصاص INS في بيض العثة.
بنية
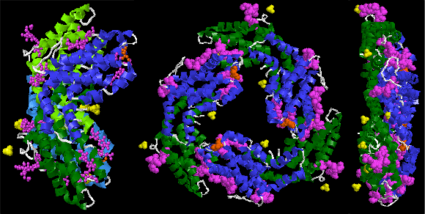
يتميز هيكل البيليبروتين عادة بالكروموفوريس بيلين مرتبة في تشكيل رباعي البروم الخطي، وترتبط بيلينس بشكل متناقض إلى أبوبروتينس عن طريق سندات ثيوثير. كل نوع من البيليبروتين لديه بيلين فريدة من نوعها التي تنتمي إليها (على سبيل المثال فيكوريثروبلين هو كروموفور فيكوريثرين وفيكوسيانوبلين هو كروموفور فيكوسيانين).
يتم تجميع الفيكوبيليبروتينات معا في مجموعات منفصلة، ما يقرب من 40 nm في القطر، والمعروفة باسم فيكوبيليسومس. تحدد التغيرات الهيكلية التي ينطوي عليها اشتقاق البلينات من ايزومير biliverdin IXα النطاق الطيفي لامتصاص الضوء.
بنية البروتين البيليروبين الحشرات تختلف قليلا عن تلك النباتات والطحالب؛ لديهم بنية بلورية، حامل اللون لا تساهمي مع ئيعلى عكس phycobiliprotein ، chromophores من phycobiliprotein يبقى في الترتيب الموسع من خلال التفاعل بين حامل اللون والبروتين، و chromophores في الحشرات choleprotein-binding الدولة تمتلك هيكل بلوري دائري حلزوني
فئات البروتينات ثنائية النواة
البروتينات الدهنية
تم العثور على Phycobiliproteins في البكتيريا الزرقاء (المعروف أيضا باسم الطحالب الخضراء المزرقة) ومجموعات الطحالب مثل rhodophyta (الطحالب الحمراء) و cryptophytes. تشمل phycobiliproteins الرئيسية اختلافات phycocyanin (الصباغ الأزرق)، واختلافات phycoerythrin (الصباغ الأحمر)، و allophycocyanin (الصباغ الأزرق الفاتح)؛ كل واحد منهم يمتلك خصائص طيفية مختلفة. هذه البيليبروتينات القابلة للذوبان في الماء ليست ضرورية لعمل الخلايا. بعض الصفات الخاصة من phycobiliproteins تشمل خصائص مضادة للأكسدة ومضان عالية، ومن chromophores التي تعطي هذه البروتينات صبغة قوية. تصنف Phycobiliproteins إلى فئتين بناء على تسلسلاتها الأمينية الطرفية: تسلسلات "α-type" و "β-type". في biliproteins حيث يكون عدد البيلينات على الوحدتين الفرعيتين غير متكافئ، فإن الوحدة الفرعية التي تحتوي على المزيد من البيلينات لها تسلسل أميني من النوع β.
فيكوكرومس
فيكوكومس هي فئة فرعية من الفيكوبابيليبروتين التي تم الاعتراف بها في البداية فقط كأصباغ حسية خفيفة في البكتيريا الزرقاء. وهي تعتبر الآن تشكل جميع الأصباغ الضوئية الضوئية الممكنة، بغض النظر عن وظيفتها. كما أنها موجودة في الطحالب الحمراء. في سلسلة من المقالات الصحفية التي كتبها G.S. و L.O. Björn ، أفيد أن a و b و c و d اكتشفها العلماء الذين قاموا بتجزيء عينات من الطحالب الزرقاء والخضراء باستخدام التركيز الكهربائي.
فيتوكرومات
تم اكتشاف فيتوكرومات (المعروفة أيضًا باسم فيز) في البداية في النباتات الخضراء في عام 1945. تم التم اكتشاف الألوان النباتية (المعروفة أيضا باسم phys) في البداية في النباتات الخضراء في عام 1945. تم العثور على الصباغ الضوئي في وقت لاحق في الفطريات والطحالب ومجموعات الطحالب الأخرى بسبب تطور تسلسل الجينوم الكامل، كما هو موضح في مقال بيتر ه. السمان في مجلة Phytochromes لعام 2010.عثور على الصبغة القابلة للانعكاس في وقت لاحق في الفطريات والطحالب ومجموعات الطحالب ا
ليبوكالين (بروتينات بيليبروتينات الحشرات)
تم العثور على الليبوكالينز التي تم تحديدها على أنها البيليبروتين في مجموعة واسعة من الحشرات، ولكن بشكل رئيسي في ترتيب Lepidoptera. اكتشفها العلماء في الفراشة البيضاء الكبيرة وعدد من أنواع العثة وعث الحرير، بما في ذلك العيلانثوس وعث الحرير المنزلي، وعثة دودة القز العملاقة، وعثة صقر التبغ، وعثة العسل، وعثة القيح.
تسلسل البروتينات الصفراوية الموجودة في الحشرات الأخرى غير قشريات الجناح ليست واضحة حتى الآن، وبالتالي فإن خصائص البروتينات الدهنية لا تزال مفتوحة.
مقارنة بين البروتينات من كائنات مختلفة
في دراسة أجريت عام 1988 من قبل هوغو شير وهاموت قيصر، تم استخراج البيليبروتين من الفراشة البيضاء الكبيرة وعثة القيح وتم فحص خصائصكل منهما. وقورنت خصائصها بخصائص البيليبروتينات النباتية والطحالب، وأخذت خصائصها المميزة في الاعتبار.
النبات غير الصخري والطحالب ثنائية البروتينات التي يتم اشتقاق بيليناتها بشكل عام فقط من أيزومر IXα biliverdin ، كما أن بيلينات البروتينات ثنائية الحشرات مشتقة أيضًا من أيزومر IXγ ، والذي يوجد تقريبًا بشكل حصري في Lepidoptera. استشهدت الدراسة من M. Bois-Choussy و M. Barbier أن هذه الأصباغ الصفراوية من السلسلة IXγ مشتقة من انقسام سلائف البورفيرين في جسر الميثين C-15 (سابقًا γ)، وهو أمر غير معهود في الثدييات الأخرى والبروتينات ثنائية النبات. عندما فحص العلماء البروتينات من كل من الفراشة البيضاء الكبيرة وعثة سنور، وجدوا أن عديد الببتيدات لديهم محتوى حلزون ألفا منخفض مقارنة بالبروتينات النباتية.
كان من المفترض أن دور البيليبروتينات في الحشرات سيكون له أيضا دور يتعلق لامتصاص الضوء مماثل للدور في البيليبروتينات النباتية والطحالب. ومع ذلك، عندما تم العثور على الخصائص الكيميائية الضوئية المطلوبة لامتصاص الضوء غائبة في البيليبروتين للفراشة البيضاء الكبيرة، تم القضاء على هذه الفرضية، تليها افتراض أن تلك الخصائص الكيميائية الضوئية لا تحدث أيضا في أي بيبيليبروتينات حشرة أخرى.
واستنادا إلى هذه الفحوص، خلص إلى أن البيليبروتينات الحشرية ترتبط ارتباطا فضفاضا فقط بتلك المستمدة من النباتات والطحالب، وذلك بسبب العدد الكبير من الاختلافات التي لديها فيما يتعلق بالهيكل والتركيب الكيميائي واشتقاق البلينات والوظائف العامة.
التطبيقات
التصوير الحيوي
البروتينات الفلورية لها تأثير كبير على التصوير البيولوجي، وهذا هو السبب في choleproteins أصبح مرشح مناسب للتطبيقات بسبب مضان، التقاط الضوء، ضوء حساسية phycobiliprotein هو بروتين فلوري عالية، وقد استخدم في التصوير البيولوجيهذا التطبيق يحتاج إلى توليف البيليروبين حامل اللون من الهيم، ثم يتطلب الانقسام انزيم ملزمة البيليروبين تساهمي المقابلة ئيطريقة أخرى هي استخدام أصباغ حساس بدلا من ذلك؛ بعض الأصباغ النباتية تحتاج إلى إنزيم واحد فقط، هم اكسيژناز وتوليف حامل اللونميزة أخرى من استخدام photopigments هي أنها يمكن أن تحفز تلقائيا ملزمة على الرغم من وجود صبغة اللونية مع ضعف مضان، هذه المشكلة قد تم التخفيف من خلال الحد من هندسة البروتين
الغذاء والدواء ومستحضرات التجميل
phycobiliprotein تمتلك خصائص طبيعية مضادة الأكسدة، المضادة للالتهابات، أصباغ الطعام، أصباغ قوية كما ثبت أن علاج الأمراض مثل مرض الزهايمر والسرطانوبالنظر إلى التطبيق الواسع النطاق وإمكانات استخدام phycobiliproteins ، والباحثين قد تم البحث وتطوير أساليب إنتاج وتنقية phycobiliproteins لتلبية الطلب المتزايدهذا النوع من phycobiliprotein هو c-phycocyanin ، وجدت في سبيرولينا الفطورأحد العوامل التقييدية في هذه التطبيقات هو استقرار البروتين، لأن الأشكال الطبيعية من أجهزة الكمبيوتر الشخصية هي حساسة للغاية للضوء والحرارة في المحاليل المائية، والتي هي أيضا عرضة كما هو الحال مع غيرها من أصباغ الطعام الطبيعية، وأجهزة الكمبيوتر هي أيضا حساسة إلى حالة حمضية هذا يساعد الباحثين على تطوير أساليب لتحقيق الاستقرار في الكمبيوتر أو ثنائي الفينيل متعدد الكلور
يمكن العثور على مزيد من التفاصيل حول تطبيقات الفيكوسيانين في الغذاء والدواء هنا.
مؤشر جودة مياه الشرب
جعلت إشارات مضان تنبعث منها Phycoerythrin و Phycocyanin مناسبة لاستخدامها كأي مؤشرات للكشف عن السيانوتوكسينات مثل Microcystins في مياه الشرب. فحصت دراسة طبيعة إشارات مضان بيليبوتين بشأن شخصيتها الحقيقية وحساستها وسلوك Biliproteins في مراحل معالجة مختلفة (من الماء) مقارنة بالصرف الصحي. تم تأكيد الطابع الفعلي إشارات مضان من خلال قياسات مضان، حيث يمكن تنفيذها دون الحاجة إلى تركيز Biliproteins مسبقا. إذا كانت نسبة Biliprotein إلى Microcystin أعلى من 1، فإن إشارات مضان يمكن أن تقدر تركيزات منخفضة جدا من Microcystins. مقارنة اختبار تم إجراؤه في عام 2009 سلوك كل من Biliproteins و Microcystins المحدد MC-LR و MC-RR أثناء معالجة المياه. أظهرت نتائج الاختبار أن Biliproteins لديها وظيفة تحذير مبكرة ضد Microcystins في مراحل العلاج التقليدية التي تستخدم الأكسدة المسبقة مع Prommanganate، الكربون والكلورة المنشط. ومع ذلك، لا تحدث وظيفة الإنذار المبكر عند استخدام ثاني أكسيد الكلور كمطهر مسبق أو نهائي. من المهم بالنسبة لنسبة Biliprotein / Toxin من المياه الخام لمعرفة من أجل استخدام Biliproteins لقياسات التحكم في علاج مياه الشرب.
انظر أيضًا
- الكروموبروتينات
- بروتين المستقبلات الضوئية
قراءة متعمقة
- بيورن، جي إس وبيورن، لو (1976). «أصباغ فوتوكرومية من الطحالب الزرقاء والخضراء: Phycochromes a و b و c». فيزيولوجيا بلانتاروم . 36 (4): 297-304. دُوِي:10.1111/j.1399-3054.1976.tb02246.x .
- بيورن، جي إس وبيورن، لو (1978). «Phycochrome d ، صبغة فوتوكرومية جديدة من الطحالب الخضراء المزرقة، تشوه توليبوثريكس». فيزيولوجيا بلانتاروم . 42 (3): 321–323. دُوِي:10.1111/j.1399-3054.1978.tb04089.x .
- شروبشاير، دبليو وموهر، هـ. (1983). التكوُّن الضوئي (الطبعة الأولى.). برلين، هايدلبرغ: سبرينغر.(ردمك 978-3-642-68918-5) .
- شير، هـ. يانغ، العاشر؛ تشاو، ك. (2015). «البروتينات الحيوية وتطبيقاتها في التصوير الحيوي». كيمياء بروسيديا . 14 : 176-185. دوى: 10.1016 / j.proche.2015.03.026 .
- ستانيك فوسينيك، د. مينيك، إس. نيكوليتش، م. فيليكوفيتش، تي سي (2018). «7. سبيرولينا Phycobiliproteins كمكونات ومكملات غذائية». في جاكوب لوبيز، إدواردو.). التكنولوجيا الحيوية الطحالب الدقيقة . نوردرستيدت، ألمانيا: كتب عند الطلب. ص. 129-148.(ردمك 978-1-78923-333-9)رقم ISBN 978-1-78923-333-9 .
- شميت، دبليو. بيتزولدت، هـ. بورنمان، ك. إيمهوف، إل. مولدينكي، سي (2009). «استخدام تحديد الصبغة الزرقاء كمؤشر على السموم الزرقاء في مياه الشرب». علوم وتكنولوجيا المياه . 59 (8): 1531-1540. دوى: 10.2166 / غرب .2009.448 .