بيرين (كيمياء)
| بيرين | |
|---|---|
| التسمية المفضلة للاتحاد الدولي للكيمياء البحتة والتطبيقية | |
Pyrene |
|
| أسماء أخرى | |
Benzo[def]phenanthrene |
|
| المعرفات | |
| رقم CAS | 129-00-0 |
| بوب كيم (PubChem) | 31423 |
مواصفات الإدخال النصي المبسط للجزيئات
|
|
| الخواص | |
| الصيغة الجزيئية | C16H10 |
| الكتلة المولية | 202.25 غ/مول |
| المظهر | بلورات بيضاء |
| الكثافة | 1.21 غ/سم3 |
| نقطة الانصهار | 156 °س |
| نقطة الغليان | 404 °س |
| الذوبانية في الماء | 135 مغ/ل ماء (عملياً غير منحل) |
| في حال عدم ورود غير ذلك فإن البيانات الواردة أعلاه معطاة بالحالة القياسية (عند 25 °س و 100 كيلوباسكال) | |
|
تعديل مصدري - تعديل | |
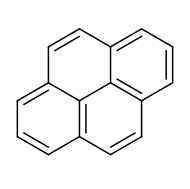
بيرين هو هيدروكربون عطري متعدد الحلقات له الصيغة الكيميائية C16H10، ويكون على شكل بلورات بيضاء عديمة اللون.
يتألف البيرين بنيوياً من اندماج أربع حلقات بنزين.
الوفرة الطبيعية
يوجد البرين طبيعياً في قطران الفحم، حيث يشكل حوالي 2% وزناً من التركيب. كما ينتج المركب عند عملية الاحتراق غير الكامل للمواد العضوية، فعلى سبيل المثال، تنتج السيارات حوالي 1 ميكروغرام من المركب في كل كيلومتر.
هناك ارتباط بين نسبة الكربون في الكون وبين الهيدروكربونات العطرية متعددة الحلقات، حيث أن أكثر من 20% من الكربون في الكون مترافق ومرتبط في مركبات PAHs، ومنها البيرين.
الخواص
يوجد المركب على شكل بلرات بيضاء/عديمة اللون، ذات انحلالية ضعيفة جداً في الماء.
يخضع البيرين للعديد من التفاعلات الكيميائية، منها تفاعل الأكسدة بالكرومات للحصول على مركب بيرينفثانون و نفثالين 8,5,4,1-رباعي حمض الكربوكسيل. كما يمكن إجراء سلسلة من تفاعلات الهلجنة،والهدرجة والنترتة، بالإضافة إلى تفاعل ديلز-ألدر.
الاستخدامات
يستخدم مركب البيرين ومشتقاته في تحضير الأصبغة. كما يستخدم كمركب معياري في مطيافية الفلورية.
المراجع
| 2 حلقة | |
|---|---|
| 3 حلقات | |
| 4 حلقات | |
| 5 حلقات | |
| +6 حلقات | |
| هيدروكربونات أليفاتية مشبعة |
|
||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| هيدروكربونات أليفاتية غير مشبعة |
|
||||||||||||||||||||||
| هيدروكربونات عطرية |
|
||||||||||||||||||||||