فيروس العوز المناعي البشري
| فيروس العوز المناعي البشري | |
|---|---|
|
رسم تخطيطي لفيروس العوز المناعي البشري.
| |
| الوبائيات | |
| انتشار المرض | 0.0075
|
| التاريخ | |
| وصفها المصدر | موسوعة لاروس الإلكترونية |
|
تعديل مصدري - تعديل | |
فيروس عوز المناعة البشري (بالإنجليزية: Human Immunodeficiency Virus، يعرف اختصاراً: HIV) هو أحد نوعين من الفيروسات البطيئة (مجموعة فرعية من الفيروسات الراجعة) التي تصيب البشر وتُسبِب بمرور الوقت متلازمة العوز المناعي المكتسب (إيدز)، وهي حالة مرضية يسمح فيها فشل الجهاز المناعي المتزايد للعداوى الانتهازية والسرطانات المهدِدة للحياة بإصابة الجسم والتمكن منه. من دون علاج، يُقدر معدل البقاء على قيد الحياة بعد الإصابة حوالي 9 إلى 11 سنة، وذلك حسب نوع الفيروس الفرعي. في معظم الحالات، ينتقل فيروس الإيدز جنسيا ويحدث ذلك من خلال اتصال بـ أو انتقال دم أو مذي أو مني أو السوائل المهبلية لفرد مصاب. أظهرت البحوث (سواء كان الزوجين مختلفي الجنس أو مثليين) أن فيروس الإيدز لا ينتقل عبر الجماع من دون واقي إذا كان للشريك المصاب حمل فيروسي غير قابل للكشف باستمرار. يمكن أن يحدث الانتقال غير الجنسي من الأم المصابة إلى جنينها أثناء الحمل أو الولادة عبر التعرض للدم أو السائل المهبلي الخاص بها، أو عبر حليب الثدي. يتواجد فيروس الإيدز داخل سوائل الجسم هذه كفيروس حر وكذلك داخل الخلايا المناعية المصابة.
يصيب فيروس الإيدز خلايا مهمة للغاية في جهاز المناعة البشري مثل الخلايا التائية المساعدة (وبشكل خاص الخلايا التائية التي تعبر على البروتين السكري كتلة التمايز 4، CD4+)، البعميات الكبيرة، والخلايا المتغصنة. تؤدي الإصابة بفيروس الإيدز إلى مستويات منخفضة من الخلايا التائية المساعدة عبر عدة آليات منها: استماتة الخلايا التائية المصابة غير المؤدية لعملها، استماتة الخلايا المجاورة غير المصابة، قتل الفيروس المباشر للخلايا المصابة، وقتل الخلايا التائية المساعدة CD4+ بواسطة الخلايا التائية القاتلة CD8+ التي تتعرف على الخلايا المصابة. حين ينخفض عدد الخلايا التائية المساعدة تحت مستوى ضروري، تُفقد المناعة التي توفرها الخلايا ويصبح الجسم حساسا بشكل متزايد للعداوى الانتهازية وهذا يؤدي إلى تطور مرض الإيدز.
علم الفيروسات
التصنيف
| النوع | الضراوة | الإعداء | الانتشار | الأصل المستنتح |
|---|---|---|---|---|
| فيروس الإيدز-1 | عالي | عالي | عالمي | الشيمبانزي الشائع |
| فيروس الإيدز-2 | منخفض | منخفض | غرب إفريقيا | المنجبي الأسخم |
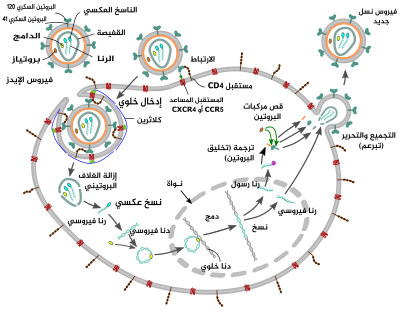
ينتمي فيروس الإيدز إلى جنس الفيروسات البطيئة، وهو جزء من عائلة الفيروسات الراجعة. للفيروسات البطيئة العديد من الأشكال البنيوية والخصائص البيولوجية المشتركة. تُصاب العديد من الأنواع بالفيروسات البطيئة التي تتميز بطول فترة حضانتها وبكونها مسؤولة عن أمراض طويلة الأمد. الفيروسات البطيئة هي فيروسات رنا مفرد السلسلة موجب الاتجاه مغلفة. عند دخولها إلى الخلية الهدف، يحوّل (ينسخ عكسيا) جينوم الرنا الفيروسي إلى سلسلة دنا مزدوجة بواسطة إنزيم مشفٍَّر في جينوم الفيروس وهو الناسخ العكسي الذي يكون موجودا في الفيروس إلى جانب الجينوم الفيروسي. بعد ذلك يُنقل الدنا الفيروسي الناتج إلى نواة الخلية ويُدمج مع الدنا الخلوي بواسطة إنزيم مشفّرٍ في جينوم الفيروس هو الدامج وعوامل مرافقة من الخلية المضيفة. حين يتم دمجه، يمكن أن يصبح الفيروس كامنا لمدة غير محددة من الزمن وذلك لتجنب اكتشافه هو والخلية المضيفة من قبل الجهاز المناعي. يمكن أن يبقى فيروس الإيدز في سبات في جسم الإنسان حتى 10 سنوات بعد الإصابة الأولية، وخلال هذه الفترة لا يُسبب الفيروس أعراضا. ويمكن أن يُنسخ الدنا الفيروسي المدمج وينتج منه جينومات رنا وبروتينات فيروسية جديدة -باستخدام موارد الخلية المضيفة وماكينة النسخ فيها- يتم تجميعها وتحريرها من الخلية كفيروسات جديدة ستبدأ بدورها دورة تضاعف من جديد.
حُددت خصائص نوعين من فيروس الإيدز: فيروس الإيدز-1 وفيروس الإيدز-2. فيروس الإيدز-1 هو الفيروس الذي اكتُشِف في البداية وسُمي بالاسمين: الفيروس المرتبط بتضخم العقد اللمفية (LAV) والفيروس الأليف للمفاويات التائية البشرية 3 (HTLV-III). فيروس الإيدز-1 أشد ضراوة وأكثر إعداءً من فيروس الإيدز-2، ويسبب معظم الإصابات بفيروس الإيدز عالميا. فيروس الإيدز-2 أقل إعداء مقارنة بفيروس الإيدز-1، ويعنى ذلك أن عددا أقل من المعرضين لفيروس الإيدز-2 ستتم إصابتهم في كل تعرض. بسبب قدرته الضعيفة نسبيا في الانتشار، فيروس الإيدز-2 محصور بشكل كبير في غرب إفريقيا.
البنية والجينوم
فيروس الإيدز مختلف في البنية عن بقية الفيروسات الراجعة، فهو كروي الشكل تقريبا وقطره حوالي 120 نانومتر، أصغر بحوالي 60 مرة من خلية الدم الحمراء. يتكون الفيروس من نسختي سلسلة رنا مفردة موجبة الاتجاه تشفران جينات الفيروس التسعة وهما محاطتين بقفيصة مخروطية تتكون من ألفي نسخة من البروتين الفيروسي P24. سلسلة الرنا المفردة مرتبطة بإحكام مع بروتينات القفيصة المنواة P7، والإنزيمات المطلوبة لنسخ ودمج وتجميع الفيروسات الجديدة مثل الناسخ العكسي، البروتيازات، الريبونوكليازات والدامج. يحيط مطرس مكون من البروتين الفيروسي p17 بالقفيصة لضمان سلامة الفيروس.
المطرس بدوره محاط بغلاف فيروسي مكون من ليبيد ثنائي الطبقة مأخوذٍ من الغشاء البلازمي الخاص بالخلية المضيفة البشرية حين يتشكل جسيم الفيروس الجديد ويتبرعم منها. يحتوي الغلاف الفيروسي على بروتينات من الخلية المضيفة ونسخا قليلة نسبيا من بروتين غلاف فيروس الإيدز، الذي يتكون من قبعة مكونة من ثلاث جزيئات تعرف بالبروتين السكري 120 (gp 120) وجذع يتكون من ثلاث جزيئات من البروتين السكري gp41 يعمل على إرساء هذه البنية في الغلاف الفيروسي. يسمح بروتين الغلاف الفيروسي المشفَّر بواسطة جين فيروس الإيدز إنف للفيروس بالارتباط بالخلية الهدف ودمج الغلاف الفيروسي مع الغشاء البلازمي للخلية وتحرير المحتوى الفيروسي داخل الخلية والشروع في دورة التكاثر والإعداء.
لكونه البروتين الفيروسي الوحيد على سطح الفيروس، بروتين الغلاف هدف رئيسي لمجهودات تطوير لقاح لفيروس الإيدز. أزيد من نصف كتلة حسكة الغلاف الثلاثية هي غليكانات مرتبطة بالنيتروجين. كثافة الغليكانات عالية لأنها تقي البروتين الموجود أسفلها من تحييده بواسطة الأجسام المضادة، وهو أحد أكثر الجزيئات المعروفة غلكزةً والكثافة عالية لدرجة تمنع عملية النضوج العادية للغليكانات أثناء التخلق في الشبكة الإندوبلازمية وجهاز غولجي. معظم الغليكانات نتيجة لذلك هي غليكانات متوقفة غير ناضجة غنية بالمانوز لا تتواجد عادة في البروتينات السكرية البشرية التي تُفرز أو الموجودة على سطح الخلية. المعالجة غير الاعتيادية والكثافة العالية تعني أن تقريبا جميع الأجسام المضادة التي تم تحديدها (من مجموعة جزئية من المرضى المصابيين بالفيروس منذ شهور أو سنوات) ترتبط بغليكان الغلاف هذه أو تتأقلم لتتكيف معها.
تم تحديد البنية الجزيئية للحسكة الفيروسية بواسطة علم البلورات السينيوالمجهرية فائقة البرودة. هذه التقدمات في البيولوجيا البنيوية كانت ممكنة بفضل تطوير نسخ مستقرة مأشوبة من الحسكة الفيروسية عبر إضافة رابطة ثنائي كبريتيد بين الوحدات وطفرة من إيزوليوسين إلى برولين (تبديل جذري لحمض أميني) في البروتين السكري gp41. نسخ الحسكة المطورة هذه المسماة الـSOSIP ثلاثي القسمات لا تحاكي الخصائص المستضدية للحسكة الفيروسية الطبيعية وحسب، بل تحتوي تقريبا على نفس كمية الغليكانات كما هو الحال في الفيروس الطبيعي. الحسكات الفيروسية المأشوبة ثلاثية القسمات هي مرشحات لقاحات واعدة لأنها تُظهر حاتمات غير مسببة للتحييد أقل من البروتين السكري المأشوب أحادي القسمات gp120، الذي يعمل على كبت استهداف الجهاز المناعي للحاتمات.

يتكون جينوم الرنا على الأقل من سبع معالم بنيوية هي (LTR وTAR وRRE وPE وSLIP وCRS وINS) وتسع جينات (gag وpol وenv وtat وrev وnef وvif وvpr وvpu وأحيانا جين عاشر tev وهو اندماج للجينات tat وenv وrev) تشفر 19 بروتينا. تحتوي ثلاثة من هذه الجينات -gag وpol وenv- على المعلومات المطلوبة لتخليق البروتينات البنيوية لبناء فيروسات جديدة. على سبيل المثال يشفِّر الجين env بروتينا يسمى gp160 يُقص بواسطة بروتياز خلوي لإنتاج بروتيني gp120 وgp41. الجينات الستة الباقية: tat وrev وnef وvif وvpr وvpu (أو vpx في حالة فيروس الإيدز-2) هي جينات تنظيمية تنتج بروتينات تتحكم في قدرة فيروس الإيدز على إصابة الخلايا وإنشاء نسخ جديدة من الفيروس (التضاعف) أو إحداث المرض.
بروتينَيْ tat (p16 وp14) هما منشطان-مفروق نسخيان لمحفز LTR ويعملان عبر الارتباط بعنصر الرنا TAR . يمكن أن يُعالَج TAR إلى جزيئات رنا ميكروي تقوم بتنظيم جينَيْ الاستماتة ERCC1 وIER3. بروتين Rev (p19) له دور كذلك في تمكيك (نقل وحماية) جزيئات الرنا من النواة والسيتوبلازم عبر الارتباط بعنصر الرنا RRE. يمنع بروتين vif (p23) عمل APOBEC3G (وهو بروتين خلوي يقوم بنزع أمين السيتيدين وتحويله إلى يوريدين في سلسلة الدنا المفردة الفيروسية و/أو التدخل في عمل الناسخ العكسي). يوقف بروتين Vpr (p14) انقسام الخلية في نقطة التحقق M-G2. بروتين nef (p27) ينظم بالإنقاص بروتين CD4 (المستقبل الرئيسي للفيروس)، وكذلك القسم 1 والقسم 2 من معقد التوافق النسيجي الكبير.
يتآثر بروتين Nef كذلك مع نطاق SH3. بروتين vpu (p16) يؤثر على على تحرير الفيروسات الجديدة من الخلايا المصابة. تسمى نهايتا كل سلسلة من رنا فيروس الإيدز بالتكرار الطرفي الطويل (LTR)، وتعمل مناطقٌ في التكرار الطرفي الطويل كمفاتيح تحويل للتحكم في إنتاج الفيروسات الجديدة ويمكن أن تُثارَ بواسطة بروتينات من الفيروس أو من الخلية المضيفة. عنصر Psi له دور في تجميع الجينوم الفيروسي ويتم تنظيمه بواسطة بروتينات gag وrev. عنصر SLIP (TTTTTT) له دور في انزياح الإطار في إطار القراءة gag-pol المطلوب لإنتاج بروتين pol وظيفي.
الانتحاء
يشير مصطلح انتحاء فيروسي إلى أنواع الخلايا التي يمكن أن يصيبها الفيروس. يمكن لفيروس الإيدز أن يصيب مجموعة متنوعة من الخلايا المناعية مثل الخلايا التائية المساعدة (CD4+)، البلعميات، والخلايا الدبقية الصغيرة. يتوسَّط دخولَ فيروس الإيدز إلى البلعميات والخلايا التائية المساعدة تآثرُ البروتين السكري الخاص بغلاف الفيروس (gp120) مع جزيء كتلة التمايز 4 الموجود على غشاء الخلية المستهدفة وكذلك مع مستقبلات الكيموكين المساعدة.
تستخدم سلالات فيروس الإيدز-1 المنتحية للبلعميات، أو غير المحدِثة للملتحم الخلوي (NSI، تسمى الآن فيروسات R5) مستقبل الكيموكين-بيتا -CCR5- للدخول وبذلك تكون قادرة على التضاعف في كل من البلعميات والخلايا التائية المساعدة. يُستخدم المستقبل المساعد CCR5 تقريبا بواسطة جميع فيروسات الإيدز-1 المعزولة بغض النظر عن النوع الجيني الفرعي للفيروس. بالفعل، تلعب البلعميات دورا مفتاحيا في جوانب حاسمة عديدة من الإصابة بفيروس الإيدز. حيث يظهر بأنها أول الخلايا المصابة بالفيروس وربما مصدر إنتاج فيروسات الإيدز حين تصبح الخلايا التائية المساعدة مستنفذة لدى المريض. البلعميات والخلايا الدبقية الصغيرة هي الخلايا التي يصيبها فيروس الإيدز في الجهاز العصبي المركزي. في الزوائد الأنفية ولوزات المرضى المصابين بالفيروس، تندمج البلعميات إلى خلايا عملاقة متعددة النوى تقوم بإنتاج كميات كبيرة من الفيروس.
تتضاعف سلالات فيروس الإيدز-1 المنتحية للخلايا التائية، أو السلالات المحدِثة للالتحام الخلوي (SI تسمى الآن فيروسات X4) في الخلايا التائية المساعدة الأساسية وكذلك في البلعميات، وتستخدم مستقبل الكيموكين-ألفا -CXCR4- للدخول.
يُعتقد أن سلالات فيروس الإيدز-1 ثنائية الانتحاء هي سلالات انتقالية من فيروس الإيدز-1 وبالتالي تكون قادرة على استخدام كل من CCR5 وCXCR4 كمستقبلات مساعدة للدخول إلى الخلية.
يثبط الكيموكين-ألفا SDF-1 -وهو ربيطة للمستقبل CXCR4- تضاعف فيروسات الإيدز-1 المعزولة المنتحية للخلايا التائية، ويقوم بذلك عبر تخفيض التعبير عن CXCR4 في سطح الخلايا التي يستهدفها الفيروس. فيروسات الإيدز-1 المعزولة المنتحية للبلعميات التي تستخدم المستقبل CCR5 فقط تسمى R5، أما التي تستخدم المستقبل CXCR4 فقط فتسمى X4، والتي تستخدم كلا المستقبلين تسمى X4R5. استخدام المستقبلات المساعدة وحدها لا يفسر الانتحاء الفيروسي، فما كل فيروسات R5 قادرة على استخدام CCR5 الموجود على البلعميات لإحداث إصابة فعالة ويمكن كذلك لفيروس الإيدز إصابة أنواع فرعية من الخلايا المتغصنة النخاعية، التي ربما تكون خزانا يحافظ على الإصابة حين تنخفض أرقام الخلايا التائية المساعدة إلى مستويات دنيا قياسية.
بعض الأشخاص مقاومون لبعض سلالات فيروس الإيدز. على سبيل المثال: الأفراد الذين لديهم طفرة CCR5 مقاومون للإصابة بفيروس R5 لأن الطفرة تجعل فيروس الإيدز غير قادر على الارتباط بهذا المستقبل المساعد، وهو ما يخفض قدرته على إصابة الخلايا المستهدفة.
الجماع هو النمط الرئيسي لانتقال فيروس الإيدز، وكلا السلالات X4 و R5 تتواجد في السائل المنوي، وهو ما يسمح للفيروس بالانتقال من الذكر إلى شريكه الجنسي. يمكن لفيروسات الإيدز إصابة العديد من الأهداف الخلوية والانتشار في كافة أنحاء الكائن. مع ذلك، تؤدي عملية انتقاءٍ إلى الانتقال الرئيسي لفيروس R5 عبر هذا النمط والمسار الجنسي. في المرضى المصابين بالنوع الفرعي فيروس الإيدز-1 B، عادة ما يكون هنالك استبدالٌ للمستقبل المساعد في المرحلة المتقدمة من المرض وعادة ما تنتج مغايِرات منتحية للخلايا التائية يمكنها إصابة صنوفٍ من الخلايا التائية عبر CXCR4. بعدها تتضاعف هذه المغايرات بمعدل أكبر وتشتد ضراوتها مسببة نفاذ الخلايا التائية السريع، وانهيار الجهاز المناعي وحدوث الإصابات الانتهازية التي تكون علامة لمرحلة متقدمة من مرض الإيدز. يصاب المرضى المصابون بفيروس الإيدز بطيف واسع من العداوى الانتهازية والتي كانت سابقا تسبب إشكالات قبل بداية العلاج عالي الفاعلية بمضادات الفيروسات الراجعة (HAART)، مع ذلك، نفس الإصابات تم التبليغ عنها بين المرضى المصابين بفيروس الإيدز المفحوصين بعد الوفاة عقب بداية العلاجات بمضادات الفيروسات الراجعة. لهذا أثناء فترة الإصابة، التأقلم الفيروسي لاستخدام مستقبل CXCR4 بدل CCR5 يمكن أن يكون خطوة رئيسية في استفحال وتطور مرض الإيدز. حددت عدة دراسات لمرضى مصابين بالفيروس الفرعي B أن بين 40-50% من مرضى الإيدز يمكنهم احتواء فيروسات من النمط الظاهري SI والنمط NSI.
فيروس الإيدز-2 أقل إمراضا من فيروس الإيدز-1 وهو محصورٌ في انتشاره العالمي في غرب إفريقيا. تبني فيروس الإيدز-2 «للجينات الملحقة» ونمطه الأكثر اختلاطا في استخدام المستقبل المساعد (بما في ذلك عدم الاعتماد على CD4) يمكن أن يساعد الفيروس في تأقلمه لتجنب عوامل التقييد الخاصة بالمناعة الفطرية الموجودة في الخلايا المضيفة. التأقلم لاستخدام الماكينة الخلوية الطبيعية لتمكين انتقال العدوى وفاعليتها ساعد أيضا فيروس الإيدز على التضاعف لدى البشر. إستراتيجية البقاء على قيد الوجود الخاصة بأي عامل إعداء هي أن لا يقتل المضيف، وإنما أن يصبح في النهاية كائنا معايشا. مع تحقيقها لإمراضية وضراوة منخفضة -بمرور الزمن- المغايرات الأكثر نجاحا في الانتقال سيتم اصطفاؤها.
دورة التضاعف
الدخول إلى الخلية

يدخل فيروس الإيدز إلى البلعميات والخلايا التائية المساعدة عبر امتزاز (ارتباط) البروتينات السكرية على سطحه بالمستقبلات الموجودة على الخلية الهدف، يتبع ذلك اندماجٌ للغلاف الفيروسي مع الغشاء الخلوي للخلية المستهدفة وتحرير قفيصة فيروس الإيدز داخل الخلية.
يبدأ الدخول إلى الخلية عبر تآثر مركب البروتين السكري ثلاثي القسمات (الحكسة gp160) الموجود على غلاف الفيروس مع كل من كتلة التمايز 4 (CD4) ومستقبل كيموكين مساعد (عادة إما CCR5 أو CXCR4، لكن يمكن أن تتآثر مستقبلات أخرى) الموجودان على سطح الخلية المستهدفة. يرتبط Gp120 مع الإنتغرين α4β7 ويُنشِّط LFA-1 -وهو الأنتغرين المركزي الذي له دور في إنشاء مشابك فيروسية- الذي يسهل الانتشار الفعال لفيروس الإيدز-1 من خلية لأخرى. تحتوي الحسكة gp160 على نطاقات ارتباط مع كل من كتلة التمايز 4 ومستقبلات الكيموكين.
الخطوة الأولى لدمج الغشائين تتم عبر الارتباط عالي الألفة بين نطاق الارتباط ببروتين كتلة التمايز 4 الخاص بـgp120 وبروتين كتلة التمايز نفسه، عندما يرتبط هذان الأخيران، يخضغ gp120 لتغير هيئي كاشفا نطاقات الارتباط بمستقبل الكيموكين الخاصة به وهذا يسمح لها بالتآثر مع مستقبل الكيموكين المستهدف. يوفر هذا الارتباط المزدوج استقرارا أكبر ويسمح للنهاية الأمينية الخاصة بببتيد الدمج gp41 باختراق الغشاء الخلوي. بعد ذلك تتآثر التسلسلات المتكررة في gp41 وHR1 وHR2 مسببة تغير بنية الجزء خارج الخلوي من gp41 إلى حلقة جذعية. تُقرِّب هذه البنية الحلقية غشائي الفيروس والخلية من بعضهما وتسمح باندماجهما ثم يلي ذلك دخول القفيصة الفيروسية إلى الخلية.
بعد ارتباط فيروس الإيدز بالخلية المستهدفة، يدخل كل من الرنا الفيروسي ومختلف الإنزيمات بما في ذلك الناسخ العكسي، الدامج، الريبونوكلياز والبروتياز إلى الخلية. وأثناء النقل المعتمد على الأنيبيب إلى النواة تُنسخ سلسلة الرنا الفيروسية عكسيا إلى سلسلة دنا مزدوجة ثم تُدمج في أحد صبغيات الخلية المضيفة.
يمكن لفيروس الإيدز إصابة الخلايا المتغصنة بواسطة الطريق CD4-CCR5، لكن يمكن أن يُستخدم طريق آخر عبر استخدام مستقبلات لكتين نوع سي (CLRs) الخاصة بالمانوز مثل DC-SIGN. الخلايا المتغصنة هي الخلايا الأولى التي يصادفها الفيروس خلال الانتقال الجنسي، ويُعتقد حاليا أنها تلعب دورا مهما عبر نقل الفيروس إلى الخلايا التائية حين يُلتقط الفيروس في الغشاء المخاطي بواسطتها. يُعتقد أن تواجد FEZ1 -الذي يظهر طبيعيا في العصبونات- يقي من إصابة الخلية بفيروس الإيدز.
كان يُعتقد لمدة طويلة أن دخول فيروس الإيدز-1 -وكذلك دخول العديد من الفيروسات الراجعة الأخرى- يحدث حصريا عند الغشاء الخلوي، لكن تم الإبلاغ حديثا كذلك عن إصابة فعالة لفيروس الإيدز-1 للخلايا بواسطة إدخال خلوي متوسَّط بالكلاثرين لا يعتمد على الأس الهيدروجيني واقتُرح مؤخرا أنه يشكل الطريق الوحيد للدخول الفعال.
التضاعف والنسخ
بعد فترة قصيرة من دخول القفيصة الفيروسية إلى الخلية، يحرر الإنزيم المسمى الناسخ العكسي جينوم سلسلة الرنا المفردة موجبة الاتجاه من البروتينات المرتبطة بها وينسخها إلى جزيء دنا متمم (cDNA). عملية النسخ العكسي عرضة للأخطاء كثيرا ويمكن أن تسبب الطفرات الناتجة مقاومة الدواء أو تسمح للفيروس بتجنب الجهاز المناعي الخاص بالجسم. للناسخ العكسي نشاط ريبونوكلياز ويقوم بتفكيك الرنا الفيروسي أثناء تخليق الدنا المتمم، وكذلك نشاط بوليميراز الدنا المعتمد على الدنا ويقوم بتخليق سلسلة دنا موجبة الاتجاه من سلسلة الدنا المتممة المضادة للاتجاه. معا، تشكل سلسلة الدنا المتممة والسلسلة المتممة لها سلسلة دنا مزدوجة فيروسية وتُنقل بعدها إلى النواة. دمج الدنا الفيروسي في جينوم الخلية المضيفة يتم بواسطة إنزيم فيروسي آخر يسمى الدامج.
يمكن أن يبقى الدنا الفيروسي المدمج في سبات أثناء مرحلة من مراحل الإصابة بالفيروس تسمى كمون الفيروس. لتخليق الفيروس بفعالية، يجب أن تتوفر عوامل نسخ محددة، وأكثرها أهمية هو NF-κB (العامل النووي كابا B)، الذي يُنظَّم بالزيادة حين تصبح الخلايا التائية منشطة. هذا يعني على الأرجح أن الخلايا التي يستهدفها فيروس الإيدز ويدخل إليها ويقتلها في النهاية هي الخلايا التي تحارب الإصابة بنشاط.
أثناء تضاعف الفيروس تُنسخ طليعة فيروس الدنا إلى جزيئات رنا ويخضع بعضها لعمية وصل الرنا لإنتاج جزيئات رنا رسول بالغة، بعد ذلك تُصدّر جزيئات الرنا الرسول هذه من النواة إلى السيتوبلازم أين تتم ترجمتها إلى البروتينات المنظمة tat (الذي يشجع على عمليات تخليق جديدة للفيروس) وRev الذي يرجع عند تخليقه إلى النواة ويرتبط بنسخ رنا فيروسية غير موصولة كاملة الطول ويسمح لها بمغادرة النواة. تعمل بعض جزيئات الرنا كاملة الطول هذه كنسخ جديدة من جينوم الفيروس، بينما تعمل أخرى كجزيئات رنا رسول تُترجَم لإنتاج البروتينات البنيوية Gag وEnv. ترتبط بروتينات Gag بجينوم الرنا الفيروسي لتجّمعه مع بروتينات أخرى لتشكيل فيروسات جديدة.
يبدو أن فيروس الإيدز-1 وفيروس الإيدز-2 يجمَّعان بطريقة مختلفة عند إنشاء فيروسات جديدة. يُجمَّع فيروس الإيدز-1 من أي جزيئة رنا مناسبة. بينما يجمع فيروس الإيدز-2 بشكل انتقائي من جزيئة الرنا الرسول التي استُخدمت لإنشاء بروتين Gag الذي يقوم بتجميعها.
التأشُّب
يُحاط جينومي رنا اثنين بقفيصة عند إنتاج فيروس إيدز-1 جديد (انظر بنية وجينوم فيروس الإيدز).يمكن أن يحدث تأشيب (إعادة تركيب) بين الجينومين عند تحفيز النسخ والتضاعف بواسطة الناسخ العكسي. يحدث التأشيب حين تُنسخ جينومات الرنا مفردة السلسلة موجبة الاتجاه عكسيا لتشكيل دنا، حيث يمكن للناسخ العكسي إنتاج جزيئة دنا عبر التبديل بين جزيئتي الرنا اللتين ينسخ منهما عدة مرات، ويسمى هذا النوع من التأشيب بتأشيب اختيار النسخ. يمكن أن تظهر حوادث التأشيب في أي نقطة من الجينوم، ومعدل حدوثها يتراوح من 2 إلى 20 حادثة تأشيب خلال كل دورة تضاعف، ويمكن لهذه الأحداث بسرعة خلط وتغيير المعلومة الجينية التي تنتقل من الجينوم الأبوي إلى الذرية.
يُنتِج التأشيب الفيروسي تغيرا جينيا يساهم على الأرجح في تطور مقاومة الفيروس للعلاج بمضادات الفيروسات القهقرية. يمكن أن يساهم التأشيب كذلك -نظريا- في التغلب على الدفاعات المناعية للكائن المضيف. مع ذلك، لكي تحدث التأقلمات والميزات الإيجابية من هذه التغيرات الجينية، يجب أن يكون الجينومان المجمعان في فيروس جديد معدي قد نشآ من سلالات فيروسية سالفة مختلفةٍ في التركيب الجيني. ومن غير المعروف كم مرة يحدث تجميع خلط مثل ذلك تحت الظروف الطبيعية.
اقترح بونهوفر وزملاؤه أن تبديل القالب (السلسلة) بواسطة الناسخ العكسي يعمل كعملية ترميم للتعامل مع الشروخات والتضررات في جينوم الرنا مفرد السلسلة. واقترح هو وتيمان أن التأشيب هو تأقلمٌ لترميم التضرر الحاصل لجينومات الرنا. تبديل السلسلة القالب (تأشيب اختيار النسخ) بواسطة الناسخ العكسي يمكن أن يولِّد نسخا غير متضررة من الدنا الجينومي من نسختي جينوم رنا مفرد السلسلة متضررتين. يمكن أن تفسر وجهة النظر هذه التي تقول بوجود فائدة تأقلمية من التأشيب لدى فيروس الإيدز لماذا يحتوي كل فيروس على جينومين كاملين بدل واحد فقط. فضلا عن ذلك، وجهة النظر القائلة بأن التأشيب هو عملية ترميم تعني أن فائدة الترميم يمكن أن تحدث في كل دورة وأن هذه الفائدة يمكن تحقيقها سواء كان الجينومان مختلفين في التركيب الجيني أو لا. من وجهة نظر أن التأشيب في فيروس الإيدز هو عملية ترميم، توليد نسخا مؤشّبة سيكون نتيجة -وليس سببا- لتطور تبديل السلسلة القالب.
تسبب الإصابة بفيروس الإيدز-1 التهابا مزمنا وإنتاج أنواع الأكسجين التفاعلية. لهذا يمكن أن يكون جينوم فيروس الإيدز عرضة للإجهاد التأكسدي، بما في ذلك شروخات في سلسلة الرنا المفردة. بالنسبة لفيروس الإيدز والفيروسات بصفة عامة، تعتمد الإصابة والعدوى الناجحة على التغلب على استراتيجيات الدفاع التي تشمل في العادة إنتاج أنواع أكسجين تفاعلية ضارة ومتلفة للجينوم. وعليه اقترح ميتشود وزملاؤه أن التأشيب بواسطة الفيروسات هو تأقلمٌ لإصلاح أضرار الجينوم، وأن النسخ المتأشبة هي نواتج ثانوية يمكن أن توفر فائدة منفصلة.
التجميع والتحرير

الخطوة الأخيرة من دورة الفيروس هي تجميع فيروسات الإيدز-1 الجديدة ويحدث ذلك عند الغشاء الخلوي للخلية المضيفة. يذهب عديد البروتين Env (gp160) بعد تخليقه إلى داخل الشبكة الإندوبلازمية ثم ينقل إلى جهاز غولجي أين يتم قصه بواسطة بروتين الفيورين وينتج عنه البروتينان السكريان الخاصان بغلاف فيروس الإيدز gp41 وgp120. بعد ذلك يُنقل هذان الأخيران إلى الغشاء الخلوي الخاص بالخلية المضيفة ويقوم gp41 بإرساء وتثبيت gp120 على الغشاء. يرتبط عديدي البروتين Gag (p55) وGag-Pol (p160) كذلك بالسطح الداخلي للغشاء الخلوي إلى جانب جينوم الرنا الفيروسي عندما يبدأ الفيروس الجديد في التبرعم من الخلية المضيفة. الفيروس المتبرعم يكون غير ناضج بعد لأن عديدات البروتين gag ماتزال يجب أن تقص لتشكيل البروتينات المكونة للمطرس والقفيصة والقفيصة المنواة. وهذا القص يتم بواسطة بروتياز فيروسي تم تجميعه مع الفيروس ويمكن تثبيطه بواسطة الأدوية المضادة للفيروسات الراجعة من قسم مثبط البروتياز. بعد ذلك تتجمع مختلف المكونات البنيوية لإنتاج فيروس إيدز جديد ناضج. ولا يمكن سوى للفيروسات الناضجة إصابة خلايا أخرى.
الانتشار داخل الجسد
تسمى العملية الكلاسيكية عند إصابة فيروس لخلية ما «بالانتشار الحر إلى الخلايا» لتمييزها عن عملية إصابة جديدة معروفة حديثا تسمى «الانتشار من خلية إلى خلية». في عملية الانتشار الحر إلى الخلايا (انظر الصورة) تتبرعم فيروسات الإيدز من الخلايا التائية المصابة وتدخل إلى الدم أو السائل خارج الخلوي وبعدها تصيب خلية تائية أخرى بعد الالتقاء بها صدفة. يمكن لفيروس الإيدز كذلك أن ينتشر مباشرة من خلية لأخرى بواسطة عملية الانتشار من خلية إلى خلية التي وُصِف لها مساران. في الأول: يمكن لخلية تائية نقل الفيروس مباشرة لخلية تائية أخرى مستهدفة عبر مشبك فيروسي. والثاني: يمكن لخلية مقدمة للمستضد (APC) مثل الخلية البلعمية أو المتغصنة أن تنقل الفيروس إلى الخلايا التائية إما عبر عملية إصابة فعالة كما هو الحال لدى البلعميات أو عبر التقاط ونقل الفيروسات بشكل مفروق كما هو الحال لدى الخلايا المتغصنة. أيا كان المسار المستعمل، فقد أُبلغ أن الانتشار من خلية إلى خلية أكثر فعالية من الانتشار الحر إلى الخلايا. تساهم عدة عوامل في هذه الفعالية منها: تبرعم الفيروس المستقطب نحو موقع اتصال الخلية بالخلية، التموضع القريب للخلايا من بعضها وهو ما يخفض من مرحلة انتشار الفيروس عبر السائل، وتكدس مستقبلات دخول فيروس الإيدز على الخلايا المستهدفة في منطقة الاتصال. يُعتقد أن الانتشار من خلية إلى خلية مهم بشكل خاص في الأنسجة اللمفاوية أين تكون الخلايا التائية المساعِدة محزَّمة بكثافة ويكون احتمال تآثرها المتكرر كبيرا. دعمت دراسات التصوير أثناء الحياة مفهوم المشبك الفيروسي لفيروس الإيدز حيويا. تساهم آليات الانتشار المتعددة المتوفرة لدى فيروس الإيدز في استمرار انتشاره وتضاعفه رغم العلاجات بمضادات الفيروسات الراجعة.
تباين جيني
يختلف فيروس الإيدز عن العديد من الفيروسات في كونه يملك تباينا جينيا كبيرا، هذا التنوع هو نتيجة لدورة تضاعفه السريعة التي يتم فيها إنشاء 1010 فيروس كل يوم، بالإضافة إلى معدل طفرات كبير يقدر بحوالي 3 x 10−5 لكل نوكليوتيد لكل دورة تضاعف وكذلك الخصائص التأشيبية للناسخ العكسي.
تؤدي هذه السمات المميزة إلى نشوء العديد من مغايرات فيروس الإيدز في مريض واحد في مدة يوم واحد فقط. يزداد هذا التنوع حين تصاب خلية واحدة في نفس الوقت بنوعين (مغايرتين) أو أكثر من فيروس الإيدز. عندما تحدث الإصابة المتزامنة، يمكن أن يتكون جينوم فيروسات الذرية من سلاسل رنا من سلالتين مختلفتين. بعدها يصيب هذا الفيروس الهجين خلية جديدة ويخضع لدورة تضاعف، وحين يتم ذلك يولِّد الناسخ العكسي عبر تبديل النسْخ بين السلسلتين جيئة وذهابا تسلسل دنا راجعٍ يكون مؤشبا (توليفة) بين جينومي الفيروسين الأبوين. يبدو هذا التأشيب جليا حين يحدث بين الأنواع الفرعية.
تطوَّرَ فيروس العوز المناعي السعالي (SIV) ذو الصلة القريبة من فيروس الإيدز البشري إلى العديد من السلالات، وصُنف حسب الأنواع الطبيعية المضيفة له. يُعتقد أن سلالات الفيروس السعالي الخاصة بالقرد الإفريقي الأخضر (SIVagm) والمنجبي الأسخم (SIVsmm) لها تاريخ تطوري كبير مع مضيفاتها. تأقلمت هذه المضيفات مع تواجد الفيروس فيها، وهذا التواجد يكون بمستويات كبيرة لكن لا يُحدث سوي استجابة مناعية خفيفة، لا تسبب تطور متلازمة نقص المناعة المكتسبة للسعالي، ولا يخضع لطفرات وتأشُّب كثيف كما هو الحال لدى فيروس الإيدز البشري (HIV).
في المقابل، حين تصيب هذه السلالات الأنواع التي تأقلمت مع فيروس عوز المناعة السعالي (SIV) مثل المكاك الريسوسي أو مكاك طويل الذيل، تطور هذه الحيوانات مرض الإيدز ويولِّد الفيروس تنوعا جينيا مماثلا لما يُشاهَد لدى إصابة البشر بالفيروس. الفيروس السعالي الخاص بالشامبانزي (SIVcpz) هو أقرب الأقارب الجينية لفيروس الإيدز-1 وهو مرتبط بزيادةٍ في الوفيات وأعراض مشابهة لأعراض الإيدز لدى مضيفه الطبيعي. يبدو أن الفيروس السعالي الشبمانزي انتقل حديثا نسبيا إلى جمهرتي الشامبانزي والبشر، لذلك لم يتأقلم هذان المضيفان مع الفيروس بعد. هذا الفيروس فقد كذلك وظيفة الجين صحن (كنيسة) المتواجدة لدى معظم فيروسات السعالي. في مغايرات فيروس السعالي غير المسببة للمرض، يثبط nef تنشيط الخلايا التائية عبر واسم عنقود التمايز 3 (CD3). وظيفة nef في سلالات فيروس السعالي غير الممرضة هي تخفيض التعبير السيتوكينات المعززة للاتهاب MHC-1 والإشارات التي تؤثر على تحرك وانتقال الخلايا التائية. في فيروس الإيدز-1 والفيروس السعالي الشمبانزي، لا يثبط nef تنشيط الخلايا التائية وفقد تلك الوظيفة. من دون هذه الوظيفة، على الأرجح قد يؤدي نفاذ الخلايا التائية إلى عوز المناعة.
تم تحديد ثلاث مجموعات من فيروس الإيدز-1 بناء على اختلافات في منطقة الغلاف (env) هي M وN وO. المجموعة M هي الأكثر انتشارا وتنقسم بدورها إلى ثمان مجموعات فرعية (أو كلادات) بناء على جينوماتها الكاملة التي تختلف جغرافيا. أكثر الأنواع الفرعية انتشارا هو B (المتواجد أساسا في شمال أمريكا وأوروبا)، A وD (المتواجدان أساسا في إفريقيا)، وC (المتواجد أساسا في إفريقيا وآسيا). تتفرع هذه الأنواع الفرعية من شجرة تطورية تمثل الخط التطوري للمجموعة M من فيروس الإيدز-1. الإصابة المتزامنة بنوعين مختلفين من الأنواع الفرعية تنتج عنها هيئات مؤشبة منتشرة (CRFs). في عام 2000، وهو آخر عام من دراسة أنجِزت لمعرفة الانتشار العالمي للأنواع الفرعية، كانت نتائج الإصابات كالتالي: 47.2% من النوع الفرعي C، 26.7% من النوع الفرعي A/CRF02_AG، 12.3% من النوع الفرعي B، 5.3% من النوع الفرعي D، 3.2% من النوع الفرعي CRF_AE، والبقية 5.3% كانت مكونة من أنواع فرعية وهيئات مؤشبة منتشرة أخرى. تركز معظم البحوث حول فيروس الإيدز-1 على النوع الفرعي B، ومختبرات قليلة تركز على أنواع فرعية أخرى. افتُرض أن تواجد المجموعة الرابعة "P" مبني على فيروس عُزل سنة 2009. ويبدو أن هذه السلالة مشتقة من فيروس السعالي الخاص بالغوريلا (SIVgor) الذي عُزِل من غوريلا السهول الغربية سنة 2006.
أقرب الأقرباء لفيروس الإيدز-2 هو فيروس السعالي الخاص بالمنجبي الأسخم. بما أن فيروس الإيدز-1 مشتق من فيروس السعالي الشبمانزيّ وفيروس الإيدز-2 من فيروس السعالي الخاص بالمنجبي الأسخم، التركيب الجيني لفيروس الإيدز-2 متماثل جزئيا فقط مع فيروس الإيدز-1 ويماثل بشكل أكبر نظيره لدى فيروس السعالي الخاص بالمنجبي الأسخم.
التشخيص
العديد من الأفراد المصابين بفيروس الإيدز لا يعلمون بأنهم مصابون به. على سبيل المثال، أقل من 1% من سكان المدن في إفريقيا النشطين جنسيا تم اختبارهم، وهذه النسبة أقل في المناطق السكانية النائية. زيادة على ذلك، في 2001 حوالي 0.5% فقط من النساء الحوامل اللواتي يرتدن المرافق الصحية الحضرية تم نصحهن، اختبارهن أو حصلن على نتائج فحص. ومجددا هذه النسبة أقل في المرافق الصحية الريفية. بما أن المتبرعين قد لا يعلمون بإصابتهم، فإن الدم المتبرع به ونواتج الدم المستخدمة في الطب والبحوث الطبية تفحص دوريا للكشف عن فيروس الإيدز.
اختبار فيروس الإيدز-1 ينفَّذ في البداية بمقايسة الممتز المناعي المرتبط بالإنزيم (إليزا) (ELISA) للكشف عن الأجسام المضادة للفيروس. والعينات التي لا تُظهر نتيجة تفاعلية من الفحص الأولي بالإليزا تعتبر سلبية لفيروس الإيدز، إلا إذا حدث تعرض جديد لشريك مصاب أو شريك لا تُعلم حالة فيروس الإيدز لديه. العينات التي تكون متفاعلة في فحص إليزا يُعاد اختبارها مجددا مرتين. إن كان أحد الاختبارين متفاعلا، يُبلَّغ عن العينة أنها متكررة التفاعل وتخضع لاختبار تأكيدي بواسطة اختبار تكميلي أكثر دقة (مثل تفاعل البوليميراز المتسلسل (PCR)، لطخة ويسترن، أو بشكل أقل مقايسة التألق المناعي (IFA)). فقط العينات متكررة التفاعل بالإليزا والإيجابية بواسطة مقايسة التألق المناعي أو تفاعل البوليميراز المتسلسل أو لطخة ويسترن هي التي تعتبر إيجابية لفيروس الإيدز وعلامة على الإصابة بالفيروس. قد تُظهر العينات متكررة التفاعل لإليزا أحيانا نتائج فحصٍ بلطخة ويسترن غير محددة، وهو الأمر الذي يحدث بسبب استجابةِ أجسامٍ مضادةٍ غير كاملة لفيروس الإيدز لدى شخص مصاب أو تفاعلات لا نموذجية لدى شخص غير مصاب.
رغم أن مقايسة التألق المناعي تُستخدم لتأكيد الإصابة في هذه الحالات الغامضة، إلا أن هذه المقايسة غير مستخدمة على نطاق واسع. عموما، يجب أن تُجمع عينة أخرى بعد أكثر من شهر ويُعاد اختبار الأفراد الذين نتائج اختبارهم بلطخة ويسترن غير محددة. يمكن استخدام اختبار الحمض النووي رغم توفره بشكل أقل (طريقة مضاعفة الرنا الفيروسي أو طليعة الدنا الفيروسية) للتشخيص في بعض الحالات. زيادة على ذلك، بعض العينات المفحوصة قد لا تمنح نتائج حاسمة بسبب جودة العينة المنخفضة، وفي هذه الحالات تُجمع عينة ثانية وتختبر للكشف عن الإصابة بفيروس الإيدز.
الاختبار الحديث للكشف عن فيروس الإيدز دقيق للغاية عندما تؤخذ فترة النافذة في الحسبان. يكون اختبار تقصٍ واحد صحيحا أكثر من 99% في كل مرة. يقدَّر احتمال حدوث نتيجة إيجابية خاطئة في برتوكول اختبار قياسي من خطوتين بحوالي 1 في 250 ألف لدى جمهرة سكان ذات احتمال إصابة منخفض. القيام باختبار بعد التعرض أمر يوصى به مباشرة ثم بعد ستة أسابيع، ثم ثلاث أشهر، ثم ستة أشهر.
تُظهِر التوصيات الأخيرة من مراكز السيطرة على الأمراض والوقاية منها الأمريكية أن اختبارات فيروس الإيدز يجب أن تبدأ باختبار مقايسة مناعية توليفي بين الأجسام المضادة لفيروس الإيدز-1 و2 وكذلك مستضد p24. حيث تستبعد النتيجة السلبية الإصابة بالفيروس، في حين يجب أن تُتبَعَ النتيجة الإيجابية بواسطة مقايسة مناعية تفريقية للأجسام المضادة لفيروس الإيدز-1 و2 لتحديد نوع الأجسام المضادة المتواجدة، وهذا ينتج عنه أربع احتمالات ممكنة.
- 1. فيروس الإيدز-1 (+) وفيروس الإيدز-2 (-): يعنى اكتشاف الأجسام المضادة الخاصة بفيروس الإيدز-1.
- 2. فيروس الإيدز-1 (-) وفيروس الإيدز-2 (+): يعنى اكتشاف الأجسام المضادة الخاصة بفيروس الإيدز-2.
- 2. فيروس الإيدز-1 (+) وفيروس الإيدز-2 (+): يعنى اكتشاف الأجسام المضادة لكلا فيروسي الإيدز-1 و2.
- 2. فيروس الإيدز-1 (-) أو غير محدد وفيروس الإيدز-2 (-): يجب إجراء اختبار حمض نووي لتحديد الإصابة بفيروس الإيدز-1 من عدمها.
البحوث
تشمل أبحاث فيروس الإيدز/الإيدز جميع البحوث الطبية التي تحاول منع، علاج أو شفاء فيروس الإيدز/إيدز، وكذلك البحوث الأساسية حول طبيعة الفيروس كعامل معدٍ والإيدز كمرض يُسبَّب بواسطة فيروس العوز المناعي البشري.
تشارك العديد من الحكومات ومؤسسات البحث في البحوث حول فيروس الإيدز/الإيدز. وتشمل هذه البحوث التدخلات الصحية السلوكية مثل البحوث في التربية الجنسية وكذلك تطوير العقاقير مثل بحوث مبيدات المكروبات المنتقلة جنسيا، لقاحات فيروس نقص المناعة البشرية والأدوية المضادة للفيروسات الراجعة. تشمل بعض مجالات البحوث الطبية الأخرى مواضيع مثل وقاية قبل التعرض، العلاج الوقائي بعد التعرض للفيروس، الختان وفيروس المناعة البشري وتأثيرات الشيخوخة المتسارعة.
الانتقال
| طريق التعرض | احتمال الإصابة | |||
|---|---|---|---|---|
| نقل الدم | 90% | |||
| الولادة (إلى الطفل) | 25% | |||
| تشارك تعاطي المخدرات عن طريق الحقن | 0.67% | |||
| وخز الإبرة للجلد | 0.30% | |||
| الجنس الشرجي (المتلقي)1 | 0.04–3.0% | |||
| الجنس الشرجي (المولج)1 | 0.03% | |||
| جماع قضيبي-مهبلي (المتلقي)1 | 0.05–0.30% | |||
| جماع قضيبي-مهبلي (المولج)1 | 0.01–0.38% | |||
| جنس فموي (مستقبل)1،2 | 0–0.04% | |||
| جنس فموي (المولج)1،2 | 0–0.005% | |||
|
1 بافتراض عدم استخدام واقي. 2 المصدر يشير إلى جنس فموي قام به رجل. | ||||
ينتشر فيروس الإيدز عبر ثلاثة طرقٍ رئيسية: الاتصال الجنسي، والتعرض الكافي لسوائل أو أنسجة الجسم المصابة، بالإضافة إلى انتقاله عموديًا من الأم إلى طفلها أثناء الحمل أو الولادة أو الرضاعة. لا يُصاب الشخص بفيروس الإيدز إذا تعرض للبراز، إفرازات الأنف، اللعاب، القشع، العرق، الدموع، البول، أو القيء وذلك في حال لم تكن ملوثةً بالدم. قد يُصاب الشخص بأكثر من سلالةٍ واحدة من الفيروس، ويُعرف هذا بالعدوى الإضافية بفيروس الإيدز.
جنسيًا
يعد الاتصال الجنسي مع شخصٍ مصابٍ بفيروس الإيدز أكثر الأسباب شيوعًا لانتقال الفيروس. ولكن على الرغم من هذا، فإنه لا يُوجد خطرٌ لانتقال الفيروس جنسيًا إذا كان لدى الشخص المُصاب حملًا فيروسيًا غير قابلٍ للاكتشاف؛ بسبب العلاج طويل الأمد. أثار وجود أفراد موجبي الإصابة بالفيروس غير ناقلين للعدوى بسبب العلاج بمضادات الفيروسات جدلا حين نُشر البيان السويسري في 2008، وأصبح منذ ذلك الحين مقبولا على أنه سليم طبيا.
عالميا، أكثر طريقة لانتقال فيروس الإيدز هي عبر الاتصال الجنسي بين أفراد من جنس مختلف، لكن نمط الانتقال يختلف بين البلدان. فاعتبارا من 2017، حدث معظم الانتقال في الولايات المتحدة بين الرجال الذين مارسوا الجنس مع رجال (82% من حالات الإصابة الجديدة هي بين ذكور أعمارهم 13 سنة فما فوق وهي 70% من مجموع الإصابات الجديدة). في الولايات المتحدة، يمثل الرجال المثليون ومزدوجو الميول الجنسي المتراوحة أعمارهم بين 13 و24 سنة حوالي 92% من الإصابات الجديدة بفيروس الإيدز بين جميع الرجال في فئتهم العمرية و27% من الحالات الجديدة بين جميع الرجال المثليين ومزدوجي الميول الجنسي. حوالي 15% من الرجال المثليين ومزدوجي الميول الجنسي مصابون بفيروس الإيدز، في حين أن 28% من النساء المتحولات جنسيا موجبات الإصابة كذلك في الولايات المتحدة.
بالنسبة لاتصال جنسي مغاير من دون وقاية، يبدو أن تقدير خطر انتقال فيروس الإيدز لكل ممارسة مرتفع أربع إلى عشر مرات في البلدان الفقيرة منه لدى البلدان الغنية. في البلدان الفقيرة، يُقدر خطر انتقال الفيروس من أنثى إلى ذكر بـ 0.38% لكل ممارسة، ومن ذكر لأنثى بـ 0.30% لكل ممارسة والتقديرات المماثلة في البلدان الغنية هي 0.04% لكل ممارسة من أنثى لذكر و0.08% لكل ممارسة من ذكر لأنثى. خطر الانتقال من جماع شرجي مرتفع بشكل خاص، ويُقدر بـ 1.4–1.7% لكل ممارسة في كلا الاتصالين المتغاير والمثلي. رغم أن انتقال الفيروس من ممارسة جنس فموي منخفض نسبيا، إلا أنه مازال موجودا. وُصِف خطر الإصابة بالفيروس من جنس فموي «بالمنعدم تقريبا»، ومع ذلك تم الإبلاغ عن بعض الحالات. يُقدر خطر كل فعل أو ممارسة بـ 0–0.04% للجنس الفموي المُتلقَى. في ظروف الدعارة في البلدان الفقيرة، قُدر خطر انتقال الفيروس من أنثى إلى ذكر بـ 2.4% لكل ممارسة و0.05% من ذكر لأنثى لكل ممارسة.
يزيد خطر الانتقال عند وجود العديد من الأمراض المنقولة جنسياوالقرحات التناسلية. ترتبط أمراض منتقلة جنسيا أخرى مثل: السيلان، داء المتدثرات، داء المشعرات والتهاب المهبل البكتيري بارتفاع نسبي صغير في خطر الانتقال. الحمل الفيروسي للفرد المصاب هو عامل خطر مهم في كلا طريقتي الانتقال: الجنسي، ومن الأم إلى الابن. أثناء الشهرين ونصف الأولى من الإصابة بفيروس الإيدز، مقدار إعداء الفرد مرتفع 12 مرة بسبب الحمل الفيروسي الكبير. إذا كان الفرد في المراحل الأخيرة من الإصابة، فإن معدلات الانتقال تكون أكبر حوالي ثماني مرات.
لعمال الجنس التجاري (ومنهم الذين يعملون في الإباحية) احتمال متزايد في الإصابة بفيروس الإيدز. يمكن أن يكون الجماع الخشن عاملا مرتبطا بزيادة الانتقال. ويُعتقد كذلك أن الاعتداء الجنسي يمكن أن يزيد انتقال فيروس الإيدز لأن الواقيات الذكرية نادرا ما تُستخدم، ومن المرجع أن يسبب رضة للمهبل أو المستقيم، كما أن هنالك خطرا كبيرا لانتقال الامراض جنسيا أثناء العلاقات المتعددة المتزامنة.
سوائل الجسم
ثاني أكثر الطرق تواترا لانتقال فيروس الإيدز هي عبر الدم ونواتج الدم. يمكن أن يحدث الانتقال عبر الدم أثناء تشارك الحقن خلال تعاطي المخدرات الوريدي، جروح وخز الإبر، نقل الدم أو نواتج الدم الملوثة، أو الحقن الطبي بوسائل غير معقمة. يُقدر خطر الإصابة من تشارك حقنة مخدرات بين 0.63% و2.4% لكل فعل بمتوسط 0.8%. ويُقدر خطر اكتساب فيروس الإيدز من وخزة إبرة من فرد مصاب بالفيروس بـ 0.3% (1 من 333) لكل فعل، والخطر الذي يلي تعرض للأغشية المخاطية لدم ملوث بـ0.09% (1 من 1000) لكل فعل. يمكن أن يرتفع هذا الخطر إلى 5% إذا كان الدم الذي دخل الجسم من فرد له حمل فيروسي كبير وكان الجرح عميقا. في الولايات المتحدة شكل متعاطو المخدرات بالحقن حوالي 12% من جميع الإصابات الجديدة بفيروس الإيدز عام 2009، وفي بعض المناطق أكثر من 80% من الأشخاص الذين يتعاطون المخدرات بالحقن موجبو الإصابة بفيروس الإيدز.
ينتقل فيروس الإيدز في 90% من حالات نقل الدم عند نقل دم يحتوي على الفيروس. خطر اكتساب فيروس الإيدز في الدول المتطورة من نقل الدم منخفض جدا (أقل من مرة لكل نصف مليون عملية نقل) حيث يُنفذ هناك برنامج اختيار متطور للمتبرعين عبر فحص الدم ضد وجود فيروس الإيدز، على سبيل المثال يبلغ خطر الانتقال في المملكة المتحدة مرة لكل خمسة ملايين نقل وفي الولايات المتحدة كان مرة في 1.5 مليون نقل سنة 2008. في البلدان الفقيرة، يتم فحص نصف عمليات النقل فقط بشكل مناسب (اعتبارا من 2008)، ويُقدر أن 15% من الإصابات بفيروس الإيدز في هذه المناطق سببها نقل دم أو نواتج دم مصاب وهو ما يمثل 5% إلى 10% من الإصابات العالمية. من الممكن اكتساب فيروس الإيدز من زراعة الأعضاء والأنسجة، رغم أن ذلك نادر بسبب الفحص.
يلعب الحقن الطبي غير الآمن دورا في انتشار الفيروس في إفريقيا جنوب الصحراء. في 2007، أُرجع ما بين 12% و17% من الإصابات في هذه المنطقة إلى استخدام الحقن الطبي. تُقدر منظمة الصحة العالمية خطر الانتقال نتيجة الحقن الطبي في إفريقيا إلى 1.2%. ترتبط أخطار انتقال الفيروس كذلك بالإجراءات الباضعة، الولادة المساعَدَة، وصحة الأسنان في هذه المنطقة من العالم. الأشخاص الذين ينفذون أو يحصلون على وشوم، ثقوب أو تنديب هم نظريا عرضة لخطر الإصابة لكن لم تُوثق حالات مؤكدة. من غير الممكن للبعوضيات أو حشرات أخرى نقل فيروس الإيدز.
الأم إلى الإبن
يمكن أن ينتقل فيروس الإيدز من الأم إلى الطفل أثناء الحمل أو أثناء الولادة أو عبر حليب الثدي أثناء الرضاعة وينتج عنه اكتساب الرضيع للفيروس كذلك. ابتداء من 2008، يسبب الانتقال العمودي حوالي 90% من حالات الإصابة لدى الأطفال. في غياب العلاج، يُقدر خطر الانتقال قبل أو أثناء الولادة بحوالي 20% ويُقدر أثناء الرضاعة بحوالي 35%. ويُخفض العلاج نسبة هذا الخطر إلى أقل من 5%.
تخفض مضادات الفيروسات الراجعة عند تناولها بواسطة الأم أو الصغير خطر الانتقال لدى النساء المرضعات. إذا لوث دمٌ الطعامَ أثناء المضغ المسبق فقد يشكل ذلك خطر انتقالٍ للفيروس. إذا لم تُعالج الأم، فإنه ينتج عن عامين من الرضاعة نسبة خطر إصابة الرضيع بمرض الإيدز تقدر بـ 17%. بسبب خطر الموت المتزايد من دون الرضاعة في العديد من المناطق في البلدان النامية، توصي منظمة الصحة العالمية إما بالرضاعة الطبيعية الخالصة أو توفير صيغة آمنة لذلك. يجب على جميع النساء المصابات بفيروس الإيدز الخضوع لعلاج بمضادت الفيروسات الراجعة مدى الحياة.
العلاج
لا يوجد حاليا أي علاج ولا لقاح فعال ضد الفيروس. ويُداوى المرضى بعلاج مضادات الفيروسات الراجعة عالي النشاط (HAART) الذي يُبطئ تقدم المرض. اعتبارا من 2010، أزيد من 6.6 مليون يتلقون هذا العلاج في الدول متوسطة الدخل والفقيرة. يشمل العلاج كذلك العلاج المباشر والوقائي للعداوى الانتهازية. اعتبارا من 2020، شُفي شخصان نهائيا من فيروس الإيدز. يبدو أن البدء السريع لعلاج مضادات الفيروسات الراجعة خلال أسبوع من التشخيص يُحسن نتيجة العلاج في الحالات متوسطة وضعيفة الدخل.
العلاج بالمضادات الفيروسية

خيارات العلاج بمضادات الفيروسات الراجعة الحالية هي توليفات تتكون من ثلاث أدوية على الأقل، تنتمي إلى صنفين -على الأقل- من العوامل المضادة للفيروسات الراجعة. في البداية، يكون العلاج عادة بمثبط الناسخ العكسي غير النوكليوسيدي (NNRTI) بالإضافة إلى نوعين من مضاهئ النوكليوسيد المثبط للناسخ العكسي (NRTIs). تشمل مضاهئات النوكليوسيد المثبطة للناسخ العكسي: زيدوفودين، تينوفوفير، لاميفودين وإمتريسيتابين. ابتداء من 2019، أدرج دولوتغرافير/لاميفودين/تينوفوفير من قبل منظمة الصحة العالمية كخط العلاج الأول للبالغين، مع إيفافيرينز/لاميفودين/تينوفوفير كبديل له. تُستخدم توليفات العوامل الحيوية التي تتضمن مثبطات البروتياز إذا فقدت الإجراءات المذكورة سابقا فعاليتها.
توصي منظمة الصحة العالمية والولايات المتحدة بمضادات الفيروسات الراجعة للأفراد في جميع الفئات العمرية (بما في ذلك النساء الحوامل) مباشرة بعد حدوث التشخيص، وذلك بغض النظر عن معدل الخلايا التائية المساعدة CD4. عند البدء في العلاج، يُوصى بأن يستمر العلاج من دون توقفات أو «عُطَلٍ». لا يُشخَّص العديد من الناس إلا بعد أن كان من الأفضل بدء العلاج. نتيجة العلاج المرجوة هي: كمية رنا فيروس الإيدز في البلازما على المدى الطويل تقل عن 50 نسخة/مل. يوصى بقياس معدلات الفيروس لتحديد إذا كان العلاج فعالا في البداية بعد أربعة أسابيع، وحين تنخفض المستويات إلى أقل من 50 نسخة/مل فمرة كل ثلاث إلى ستة أشهر تكون عادة كافية. التحكم غير الكافي يعني مستويات أعلى من 400 نسخة/مل. وبناء على هذه المعايير العلاج فعال لدى أزيد من 95% من الأفراد أثناء العام الأول.
تشمل فوائد العلاجِ: انخفاض خطر تطور الإصابة إلى مرض الإيدز وانخفاض خطر الوفاة. في العالم المتقدم، يحسن العلاج كذلك الصحة الجسمية والعقلية. مع العلاج، هنالك انخفاض بـ70% في خطر الإصابة بالسل. من الفوائد الإضافية كذلك انخفاض خطر انتقال الفيروس إلى الشريك الجنسي وانخفاض خطر انتقاله من الأم إلى الابن. تعتمد فعالية العلاج من ناحية كبيرة على الالتزام به. من أسباب عدم الالتزام بالعلاج ضعف الوصول إلى الرعاية الطبية، الدعم الاجتماعي غير الكافي، الأمراض النفسية، وإساءة استعمال العقاقير. يمكن أن يُخفض تعقيد تدابير العلاج (بسبب اختلاف عدد الحبوب وجرعاتها) والتأثيرات الضارة من الالتزام به. رغم أن التكلفة قضية مهمة في بعض الأدوية، إلا أن 47% من المحتاجين لتلك الأدوية كانوا يتناولونها في البلدان منخفضة ومتوسطة الدخل اعتبارا من 2010، ومعدل الالتزام متماثل بين الدول منخفضة الدخل والدول الغنية.
ترتبط حوادث ضارة محددة بتناول عاملٍ مضاد للفيروسات الراجعة. من بعض الأحداث الضارة الشائعة نسبيا: الحثل الشحمي المرتبط بفيروس الإيدز، عسر شحميات الدم والسكري، وخاصة مع تناول عواملِ مثبطاتِ البروتياز. من الأعراض الشائعة الأخرى الإسهال، وزيادة خطر الإصابة بمرض قلبي وعائي. ارتبطت التوصيات العلاجية الحديثة مع تأثيرات ضارة أقل. قد ترتبط بعض الأدوية مع عيوب خلقية لذلك قد تكون غير مناسبة للنساء اللواتي يرغبن بالإنجاب.
التوصيات العلاجية للأطفال مختلفة قليلا عن تلك الخاصة بالبالغين. توصي منظمة الصحة العالمية بمعالجة جميع الأطفال البالغين أقل من 5 سنوات، والأطفال البالغين 5 سنوات فما فوق يُعالجون مثل البالغين. في الولايات المتحدة توصي الإرشادات بمعالجة جميع الأطفال البالغين أقل من 12 شهرا وجميع أولئك الذين لديهم معدلات رنا فيروس الإيدز أكبر من 100 ألف نسخة/مل بين الأعمار سنة وخمس سنوات.
العداوى الانتهازية
إجراءات الوقاية من العداوى الانتهازية فعالة لدى العديد من الأشخاص المصابين بمرض الإيدز. فضلا عن تحسين حالة المرض بالإيدز، يُخفض العلاج بمضادات الفيروسات الراجعة خطر تطوير أمراض أخرى عبر العداوى الانتهازية. يجب على البالغين والمراهقين الذين يتعايشون مع فيروس الإيدز (حتى مع العلاج بمضادات الفيروسات الراجعة) من دون دليل على سل نشط في بيئة ذات عبء سل كبير تلقي علاج إيزونيازيد الوقائي، يمكن استخدام اختبار مانتو لمعرفة ما إذا كانت هناك حاجة لعلاج إيزونيازيد الوقائي. يُنصح بالتلقيح ضد الالتهاب الكبدي A وB لجميع الأفراد المعرضين لخطر اكتساب فيروس الإيدز قبل أن يصبحوا مصابين فعلا، مع ذلك يمكن أن يُعطى اللقاح بعد الإصابة. يوصى بتقديم تريميثوبريم/سلفاميثوكسازول الاحترازي بين عمر أربعة وستة أسابيع والتوقف عن الإرضاع الصغار المولودين لأم موجبة الإصابة بالفيروس في البيئات محدودة الوسائل والمصادر. يُوصى كذلك بالوقاية ضد ذات الرئة بالمتكيسة الجؤجؤية حين يصبح مستوى الخلايا التائية CD4 أقل من 200 خلية/ميكرولتر لدى الأفراد المصابين بها أو الذين أصيبوا بها سابقا. يُنصح الأفراد الذين لديهم تثبيط مناعي معتبر كذلك بتلقي العلاج الاحترازي ضد داء المقوسات وعدوى المتفطرة الطيرية الجوانية. خفضت الإجراءات الوقائية المناسبة معدل حدوث تلك العداوى بنسبة 50% بين 1992 و1997. غالبا ما يُوصى بالتلقيح ضد الإنفلونزا والتلقيح ضد المكورة الرئوية المتعدد السكاريد لدى الأفراد المصابين بمرض الإيدز لوجود بعض الفوائد لهما.
الحمية
أصدرت منظمة الصحة العالمية توصيات بخصوص الاحتياجات الغذائية لمرض الإيدز، حيث يُستحب تناول حمية غذائية صحية. توصي المنظمة المصابين بفيروس الإيدز البالغين بتناول المغذيات الدقيقة بقدر مستويات الكمية الغذائية اليومية المرجعية، ولا توصي بتناولٍ زائدٍ لفيتامين أ والزنك والحديد الذين يمكن أن يسببوا تأثيرات مختلفة إلا إذا وُجِد عوز موثق لها. يمكن أن يُقوي تناول المكملات الغذائية من قبل الأفراد المصابين بفيروس الإيدز الذين يعانون من تغذية غير كافية أو عوز غذائي جهازهم المناعي أو يساعدهم في التعافي من العداوى، لكن الدلائل التي تشير إلى الفائدة الإجمالية في التحسن من المرض أو انخفاض نسبة الوفاة غير متسقة وثابتة.
تناول مكملات السيلينيوم الغذائية مرتبط ببعض الدلائل على وجود فائدة مؤقتة غير مؤكدة. يحسن تناول النساء الحوامل والمرضعات المصابات بالفيروس لمكملات عديد الفيتامين حالة كل من الأم وصغيرها. إذا نُصحت المرأة الحامل أو المرضع بتناول أدوية مضادات الفيروسات الراجعة لمنع انتقال فيروس الإيدز منها إلى الصغير، فلا يجب أن تحل مكملات عديد الفيتامين مكان هذه الأدوية. توجد بعض الدلائل التي تشير إلى أن تناول الأطفال المصابين بفيروس الإيدز لمكملات الفيتامين أ يخفض نسبة الوفاة ويحسن النمو.
الطب البديل
في الولايات المتحدة، يستخدم حوالي 60% من الأشخاص المصابين بفيروس الإيدز أنواعا من الطب المكمل أو البديل، الذي لم يُؤكَّد تأثيره وفائدته. لا توجد دلائل كافية تدعم استخدام طب الأعشاب. ولا توجد دلائل كافية لدعم أو التوصية باستخدام القنب الطبي لمحاولة زيادة الشهية أو اكتساب الوزن.
المآل
أصبح فيروس/مرض الإيدز مزمنا بدل كونه مرضا قاتلا في العديد من المناطق بالعالم. يختلف مآل المرض بين الأشخاص، ويساهم كل من عدد الخلايا التائية المساعدة CD4 والحمل الفيروسي في معرفة النتائج. يُقدّر متوسط العمر بعد الإصابة من دون علاج بين 9-11 سنة، حسب النوع الفرعي للفيروس. بعد التشخيص بمرض الإيدز، يترواح معدل الحياة إذا لم يكن العلاج متوافر من 6 إلى 19 شهرا. يخفض علاج مضادات الفيروسات الراجعة عالي النشاط والوقاية المناسبة ضد العداوى الانتهازية نسبة الوفاة بـ80% ويزيد العمر المتوقع للبالغين الشباب المشخصين حديثا بـ 20 إلى 50 سنة. وهذا بين ثلثي وكامل مأمول الحياة لدى عامة الناس. إذا بدأ العلاج في مرحلة متأخرة من الإصابة، فإن المآل لن يكون جيدا فعلى سبيل المثال إذا بدأ العلاج بعد التشخيص بمرض الإيدز فإن العمر المتوقع هو 10-40 سنة. يموت نصف الصغار الذين ولدوا وهم مصابون بالفيروس قبل بلوغ عامين من دون علاج.

|
no data
≤ 10
10–25
25–50
50–100
|
100–500
500–1000
1,000–2,500
2,500–5,000
5,000–7500
|
7,500–10,000
10,000–50,000
≥ 50,000
|
الأسباب الرئيسية للوفاة من فيروس/مرض الإيدز هي العداوى الانتهازية والسرطان وكلاهما نتيجة متواترة لفشل الجهاز المناعي المتزايد. يزيد خطر الإصابة بالسرطان عندما يصبح عدد الخلايا التائية CD4 أقل من 500 خلية/ميكرولتر. يختلف معدل تطور المرض السريري بشكل كبير بين الأفراد وقد تبين أنه يتأثر بعدة عوامل مثل: حساسية الفرد ووظائفه المناعية، حصوله على الرعاية الصحية، الإصابة بعدوى مرافقة، وسلالة أو سلالات الفيروس التي أصيب بها.
العدوى المرافقة بالسل هي أحد الأسباب المؤدية إلى المرض والوفاة لدى الأفراد المصابين بفيروس/مرض الإيدز ويظهر السل لدى ثلث الأفراد المصابين بفيروس الإيدز ويسبب 25% من حالات الوفاة المرتبطة بالفيروس. فيروس الإيدز أحد أهم عوامل الخطر المرتبطة بالسل.التهاب الكبد سي هو عدوى مرافقة شائعة جدا يقوم فيها كل مرض بتسريع تطور المرض الآخر. السرطانات المرتبطة بفيروس الإيدز الأكثر شيوعا هي ساركوما كابوزي ولمفوما لاهودجكينية المرتبطة بالإيدز. من السطرنات الأخرى الشائعة كذلك: سرطان الشرج، لمفوما بيركت، لمفومة الجهاز العصبي المركزي الأولية وسرطان عنق الرحم.
حتى مع العلاج بمضادات الفيروسات الراجعة، بعد مدة طويلة قد يعاني الأشخاص المصابون بفيروس الإيدز من اضرابات عصبية إدراكية،هشاشة العظام،اعتلال الأعصاب المحيطية، السرطانات،اعتلال الكلية،مرض قلبي وعائي. بعض الأمراض مثل الحثل الشحمي يمكن أن يُسببها كل من الفيروس والعلاج.
الوبائيات
فيروس/مرض الإيدز جائحة عالمية. واعتبارا من 2016، يوجد حوالي 36.7 مليون شخص مصاب عالميا، بمعدل حوالي 1.8 مليون إصابة سنويا، حيث انخفض هذا العدد من 3.1 مليون إصابة سنة 2001. أزيد من النصف بقليل من الأفراد المصابين هم نساء و2.1 مليون هم أطفال. وتسبب المرض في حوالي مليون وفاة سنة 2016 كانت قد انخفضت من 1.9 مليون وفاة في 2005.
إفريقيا جنوب الصحراء هي المنطقة الأكثر تأثرا. في عام 2010، قُدِّر أن حوالي 68% (22.9 مليون) من جميع حالات الإصابة و66% من جميع حالات الوفاة (1.2 مليون) حدثت في هذه المنطقة. وهذا يعني أن حوالي 5% من البالغين في هذه المنطقة مصابون ويُعتقد أنه سبب 10% من جميع الوفيات لدى الأطفال. تشكل النساء هنا حوالي 60% من الحالات وذلك عكس بقية المناطق. تملك جنوب أفريقيا أكبر عدد من السكان المصابين بفيروس الإيدز من أي دولة أخرى بحوالي 5.9 مليون مصاب. انخفض متوسط العمر المتوقع في الدول الأكثر تأثرا بالفيروس، فعلى سبيل المثال: في عام 2006 قُدِّر أنه انخفض في بوتسوانا من 65 إلى 35 سنة. انخفض انتقال الفيروس من الأم إلى الصغير في بوتسوانا وجنوب إفريقيا اعتبارا من 2013 إلى أقل من 5%، مع العديد من التحسنات في عدة دول إفريقية وذلك بفضل تحسن الوصول إلى العلاج بمضادات الفيروسات الراجعة.
جنوب وجنوب شرق آسيا هو ثاني أكثر المناطق تأثرا، في عام 2010 احتوت هذه المنطقة حوالي 4 ملايين حالة أو 12% من جميع الأفراد المتعايشين من فيروس الإيدز ونتج عن ذلك حوالي 250 ألف وفاة. حوالي 2.4 مليون حالة من هذه الحالات توجد في الهند.
في عام 2008 بالولايات المتحدة، نتج عن 1.2 مليون شخص تقريبا يتعايشون مع فيروس الإيدز حوالي 17500 وفاة. قدرت مراكز السيطرة على الأمراض والوقاية منها أنه خلال ذلك العام 20% من الأمريكيين المصابين كانوا غير مدركين لإصابتهم. واعتبارا من 2016، توفي حوالي 675 ألف شخص في الولايات المتحدة بسبب فيروس/مرض الإيدز منذ بداية جائحة فيروس الإيدز. في المملكة المتحدة واعتبارا من 2015، توجد حوالي 101200 حالة نتج عنها 594 وفاة. في كندا واعتبارا من 2008، كانت هنالك 65 ألف حالة تسببت في 53 وفاة. بين الإدراك الأول للإيدز (عام 1981) و2009، أدى هذا المرض إلى 30 مليون وفاة. معدلات الإصابة بالفيروس هي الأخفض في شمال إفريقيا والشرق الأوسط (0.1% أو أقل)، شرق آسيا (0.1%) وغرب ووسط أوروبا (0.2%). أكثر الدول الأوروبية تضررا في حسب تقديرات 2009 و2012 هي: روسيا، أوكرانيا، لاتفيا، مولدوفيا، البرتغال، وبيلاروس، مرتبة تنازليا حسب مستوى الانتشار.
تاريخ

الاكتشاف
لوحظ مرض الإيدز سريريا لأول مرة عام 1981 في الولايات المتحدة. كانت الحالات الأولى لمجموعة من متعاطي المخدرات عبر الحقن ورجل مثلي ذو مناعة عليلة من دون سبب معروف أظهر أعراض ذات الرئة التي تسببها المتكيسة، وهي عدوى انتهازية نادرة معروفٌ بأنها تصيب الأفراد الذين جهاز المناعة لديهم ضعيف وعليل. بعد ذلك بوقت قصير طور رجل مثلي آخر سرطان جلد نادر يسمى ساركوما كابوزي. ثم تلى ذلك ظهور العديد من الإصابات بذات الرئة والسرطان، وهو ما نبه مراكز السيطرة على الأمراض والوقاية منها الأمريكية فتم تشكيل فريق عمل لمراقبة التفشي. أقدم وصف لحالة مرض بالإيدز كانت في النرويج في بداية عام 1966.
في البداية لم يكن لدى مراكز السيطرة على الأمراض والوقاية منها اسم رسمي للمرض، وغالبا ما كان يشار إليه بالمرض الذي يُحدثه، على سبيل المثال: تضخم العقد اللمفية، وهو المرض الذي سمى به مكتشفو فيروس الإيدز الفيروس أول مرة. واستخدموا كذلك ساركوما كابوزي والعداوى الانتهازية، والأخير هو الاسم الذي شُكِّل فريق العمل لمراقبته سنة 1981. في الصحافة العامة، تمت صياغة المصطلح GRID الذي يعني عوز المناعة المرتبط بالمثلي. صاغت السيديسي -أثناء بحثها عن اسم ومراقبتها للمجتمعات المصابة- مصطلح "مرض الهاءات الأربعة" لأن المرض كان يبدو بأنه يصيب المثليين، متعاطي المخدرات، المصابين بالهيموفيليا والهايتيين (جميع هذه الكلمات تبدأ بحرف H في اللغة الإنجليزية). لكن بعد معرفة أن الإيدز ليس محصورا في مجتمع المثليين، أُدرِك أن مصطلح GRID كان غير مناسب وتمت صياغة مصطلح الإيدز في اجتماع في يوليو 1982. وبحلول سبتمبر 1982 بدأت السيديسي باستخدامه.

في 1983، أعلن فريقا بحث منفصلان يقودهما الأمريكي روبرت غالو والباحثان الفرنسيان فرانسواز باري سينوسي ولوك مونتانييه بشكل منفصل أن الفيروس الراجع الجديد قد يكون هو من يصيب مرضى الإيدز، ونشروا نتائجهم في نفس الإصدار من دورية ساينس. زعم غالو أن فيروسا عزله فريقه من مريض بالإيدز كان مماثلا في الشكل لفيروسات اللمفاويات التائية البشرية (HTLV) الأخرى التي عزلها فريقه أولا. اعترف غالو في 1987 أن الفيروس الذي ادعى اكتشافه في 1984 كان في الواقع فيروسا أُرسِل إليه من فرنسا عاما قبل ذلك. سمى فريق غالو فيروسهم المعزول الجديد باسم HTLV-III. عزل فريق مونتانييه فيروسا من مريض يُبدي تورما في العقد اللمفاوية الخاصة بالرقبة وضعفا جسديا، وهما عرضين كلاسيكيين من أعراض الإصابة بفيروس الإيدز. وبشكل يخالف تقرير فريق غالو، أظهر مونتانييه وزملاؤه أن البروتينات الأساسية لهذا الفيروس كانت مختلفة مناعيا عن تلك الخاصة بفيروس HTLV-I، وسمى فريق مونتانييه فيروسهم المعزول بالفيروس المرتبط باعتلال العقد اللمفاوية (LAV). وحين تبين أن هذين الفيروسين هما نفس الفيروس، أعيد في 1986 تسمية LAV وHTLV-III بفيروس عوز المناعة البشري (HIV).
كان فريق آخر يعمل في نفس لوقت مع فريقي غالو ومونتانييه وهو فريق الدكتور جاي ليفي من جامعة جامعة كاليفورنيا، سان فرانسيسكو. وقام بشكل مستقل باكتشاف فيروس الإيدز في 1983 وسماه الفيروس الراجع المرتبط بالإيدز (ARV). كان هذا الفيروس مختلفا جدا عن الفيروس المبلغ عنه بواسطة فريقي مونتانييه وغالو. أشارت سلالة ARV -لأول مرة- إلى تغاير فيروسات الإيدز المعزولة وبقي العديد منها أمثلة على فيروسات الإيدز المكتشفة في الولايات المتحدة.
الأصل
يُعتقد أن كلا السلالتين فيروس الإيدز-1 وفيروس الإيدز-2 نشأتا من رئيسيات غير بشرية في غرب وسط إفريقيا، ويُعتقد أنها انتقلت إلى البشر (عملية تعرف بمرض حيواني المنشأ) في بداية القرن العشرين.
يبدو أن فيروس الإيدز-1 نشأ في جنوب الكاميرون عبر تطور سلالة فيروس عوز المناعة الخاص بالشامبانزي (SIVcpz) وهو فيروس عوز المناعة السعالي الذي يصيب الشامبانزي البري (فيروس الإيدز-1 ينحدر من SIVcpz المتوطنة في نويعات الشامبانزي المسماة شمبانزي الوسط). أقرب سلالة لفيروس الإيدز-2 هي فيروس السعالي الخاص بالمنجبي الأسخم وهو فيروس عوز مناعة سعالي يصيب المنجبي الأسخم (يصيب نويعا يعرف بالاسم العلمي Cercocebus atys atys)، وهو قرد من العالم القديم يعيش في سواحل غرب إفريقيا (من جنوب السنغال حتى غرب ساحل العاج).قردة العالم الجديد مثل القرد البومة مقاومة للإصابة بفيروس الإيدز-1، ربما بسبب اندماج جينومي لجينين مقاومين للفيروس. يُعتقد أن فيروس الإيدز-1 انتقل بين الأنواع في ثلاث مناسبات منفصلة، وهذا أنشأ ثلاث مجموعات فرعية من الفيروس: M وN وO.

يوجد دليل على أن البشر الذين يشاركون في نشاطات لحوم الأدغال -سواء الصيادون أو بائعو لحوم الأدغال- عادة ما يصابون بفيروس السعالي. فيروس السعالي ضعيف وعادة ما يكبحه جهاز المناعة البشري خلال أسابيع من الإصابة. يُعتقد أنه من الضروري حدوث عدة انتقالات للفيروس من فرد إلى فرد بشكل سريع ومتعاقب ليكسب وقتا يسمح له بالتطفر إلى فيروس الإيدز. زيادة على ذلك، بسبب معدل الانتقال المنخفض من فرد إلى فرد، لا يمكن للفيروس الانتشار في الجمهرة سوى أثناء وجود قناة أو أكثر من قنوات انتقال عالية الخطورة، والتي يُعتقد أنها كانت غائبة في إفريقيا قبل القرن العشرين.
تسمح قنوات انتقالٍ عاليةِ الخطورةِ محددةٌ للفيروس بالتكيف مع البشر والانتشار داخل المجتمع، وذلك حسب توقيت العبور بين الأنواع من الحيوان إلى البشر. تقترح الدراسات الجينية للفيروس أن أحدث سلف مشترك لفيروس الإيدز-1 المجموعة M يعود إلى حوالي 1910. يربط أنصار هذا التأريخ وباء فيروس الإيدز مع بروز الاستعمار ونمو المدن المستعمرة الإفريقية الكبيرة، حيث أدى ذلك إلى تغيير اجتماعي شمل مختلف أنماط الاتصال الجنسي (خاصة العلاقات المتعددة المتزامنة)، انتشار الدعارة وأمراض القرحة التناسلية المتواترة المصاحبة لها (مثل الزهري) في المدن الاستعمارية الجديدة. معدلات انتقال فيروس الإيدز أثناء الجماع المهبلي منخفضة عادة، إلا أنها يمكن أن ترتفع عدة مرات إن كان أحد الشريكين يعاني من عدوى منتقلة جنسيا ينتج عنها قرحات تناسلية. كانت المدن الاستعمارية الأولى في 1900 بارزة بسبب الانتشار الكبير للدعارة والقرحات التناسلية إلى درجة أنه اعتبارا من 1928 حوالي 45% من الإناث المقيمات في ليوبولدفيل الشرقية اعتُقد أنهن بغايا، واعتبارا من 1933 أصيب 15% من جميع المقيمين في نفس المدينة بأحد أنواع الزهري.
تعود أقدم حالة إصابة بشرية بالإيدز موثقة جيدا إلى 1959 في الكونغو البلجيكية. يمكن أن يكون أول تواجد للفيروس في الولايات المتحدة في منتصف أو أواخر العقد 1950، حيث أظهر ذكر في السادسة عشر من العمر أعراضا في عام 1966 وتوفي في 1969. تعتقد نظرة أخرى -غير مدعومة بأدلة- أن الممارسات الطبية غير الآمنة في إفريقيا أثناء الأعوام التي تلت الحرب العالمية الثانية، مثل إعادة الاستخدام غير المعقم لحقن مفردة الاستخدام أثناء حملات التلقيح الجماعي، والعلاجات بالمضادات الحيوية، والعلاجات ضد الملاريا، كانت الناقل الأولي الذي سمح للفيروس بالتكيف مع البشر والانتشار.
انظر أيضًا
المراجع
| التطور | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| الأنواع | |||||||||||
| الإدارة |
|
||||||||||
| اللقاحات |
|
||||||||||
| جدل | |||||||||||
| انظر أيضًا | |||||||||||
| |||||||||||
| أثناء الحمل/ الانتقال عبر المشيمة |
|||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| الانتقال أثناء الولادة | |||||||||||||||||
|
مناعة خلوية نقص المناعة of الحمل المتأخر |
|||||||||||||||||
| الرضاعة الطبيعية | |||||||||||||||||
| |||||||||||||||||
| صحيفة ساينس |
|
|---|---|
| وطنية | |
|---|---|
| أخرى | |
|
|||||||||||||||||||
| صحة غير إنجابية |
|
||||||||||||||||||
| عوامل سوسيو ثقافية | |||||||||||||||||||
| السياسات، الأبحاث والحماية |
|
||||||||||||||||||
| صحة المرأة حسب البلد |
|||||||||||||||||||
| التصنيفات الطبية | |
|---|---|
| المعرفات الخارجية |
|